题目内容
【题目】甲醇是有机化工原料和优质燃料,主要应用于精细化工、塑料等领域,也是农药、医药的重要原料之一。回答下列问题:
(1)工业上利用CO2和H2反应合成甲醇。已知25℃ 101kPa下:
H2(g)+![]() O2(g)═H2O(g) △H=﹣242kJmol﹣1
O2(g)═H2O(g) △H=﹣242kJmol﹣1
CH3OH(g)+![]() O2(g)=CO2(g)+2H2O(g)△H2=﹣676kJmol﹣1
O2(g)=CO2(g)+2H2O(g)△H2=﹣676kJmol﹣1
①写出CO2和H2反应生成CH3OH(g)与H2O(g)的热化学方程式______
②下列表示该合成甲醇反应的能量变化示意图中正确的是______(填字母)
a. 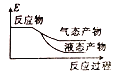 b.
b. 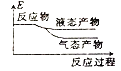 c.
c. 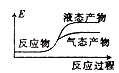 d.
d. 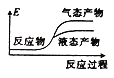
③合成甲醇所需的H2可由下列反应制取:H2O(g)+CO(g)H2(g)+CO2(g),某温度下该反应的平衡常数K=1,若起始时c(CO)=1molL﹣1,c(H2O)=2molL﹣1,则达到平衡时H2O的转化率为______
(2)CO和H2反应也能合成甲醇:CO(g)+2H2(g)CH3OH(g)△H=﹣90.1kJmol﹣1,在250℃下,将一定量的CO和H2投入10L的恒容密闭容器中,各物质浓度(molL﹣1)变化如下表所示(前6min没有改变条件)
2min | 4min | 6min | 8min | ||
CO | 0.07 | 0.06 | 0.06 | 0.05 | …… |
H2 | x | 0.12 | 0.12 | 0.2 | …… |
CH3OH | 0.03 | 0.04 | 0.04 | 0.05 | …… |
①x=______,250℃时该反应的平衡常数K=______
②若6~8min时只改变了一个条件,则改变的条件是______,第8min时,该反应是否达到平衡状态?______(填“是”或“不是”)
③该合成反应的温度一般控制在240~270℃,选择此温度的原因是:
Ⅰ.此温度下的催化剂活性;
Ⅱ.______
(3)甲醇在催化剂条件下可以直接氧化成甲酸,在常温下,20.00mL 0.1000molL﹣1NaOH溶液与等体积、等浓度甲酸溶液混合后所得溶液的pH______(填“<”“>”或“=”)原因是______(用离子方程式表示)
【答案】CO2(g)+3H2(g)═CH3OH(g)+H2O(g)△H=﹣50 kJ/mol a 33.3% 0.14 46.3 增加了1 mol氢气 不是 温度低,反应速率慢,单位时间内的产量低;而该反应为放热反应,温度过高,转化率降低; >7 HCOO﹣+H2OHCOOH+OH﹣
【解析】
(1)①据已知化学方程式,根据盖斯定律计算;
②该反应是放热反应,反应物总能量大于生成物总能量,物质越稳定,其能量越小;
③利用三段式法计算平衡状态时各物质的平衡浓度;
(2)①根据表中2min和4min时各种物质的浓度的变化量,依据转化量之比等于方程式化学计量数之比可求出x值;该反应的平衡常数表达式K=![]() ,将在250℃下,4min时各物质平衡浓度代入计算;
,将在250℃下,4min时各物质平衡浓度代入计算;
②根据6min到8min时各物质浓度的变化来确定改变条件;求出第8min时的浓度商Qc,与250℃时K做比较,若Qc=K反应达到平衡状态;
③反应条件的选择既要考虑限度又要考虑速率,二者应兼顾;
(3)甲酸钠溶液因为甲酸根的水解显碱性。
(1)① H2(g)+![]() O2(g)═H2O(g) △H=﹣242kJmol﹣1①
O2(g)═H2O(g) △H=﹣242kJmol﹣1①
CH3OH(g)+![]() O2(g)=CO2(g)+2H2O(g)△H2=﹣676kJmol﹣1②
O2(g)=CO2(g)+2H2O(g)△H2=﹣676kJmol﹣1②
将方程式3×①-②得CO2(g)+3H2(g)═CH3OH(g)+H2O(g)△H=﹣50 kJ/mol,
故答案为:CO2(g)+3H2(g)═CH3OH(g)+H2O(g)△H=﹣50 kJ/mol;
②该反应是放热反应,反应物总能量大于生成物总能量,物质越稳定,其能量越小,所以液态物质的能量小于气态物质,则符合条件的图象是a,
故选:a;
③ H2O(g)+CO(g)H2(g)+CO2(g)
起始量(mol/L)2 1 0 0
转化量(mol/L)y y y y
平衡量(mol/L)2 y 1 y y y
y 2÷[(2 y)·(1 y)]=1,解得y =![]() ,所以H2O(g)的转化率为:
,所以H2O(g)的转化率为:![]() ÷2×100%=33.3%,
÷2×100%=33.3%,
故答案为:33.3%;
(2)①从图中可知从2min到4min时各物质的转化量为:△c(CO):△c(H2):△c(CH3OH)=(0.070.06):(x0.12):(0.040.03)
化学反应中各物质的转化量之比等于方程式化学计量数之比得:(0.070.06):(x0.12):(0.040.03)=1:2:1,解得x=0.14,
250℃下,甲醇的平衡浓度是0.04mol/L,氢气的平衡浓度是0.12mol/L,一氧化碳的平衡浓度是0.06mol/L,所以平衡常数K=![]() =
=![]() =46.3,
=46.3,
故答案为:0.14;46.3;
②对比6min和8min时各物质的浓度可知改变条件后反应向正方向进行,按照转化量之比等于化学计量数之比△c(CO):△c(H2):△c(CH3OH)=1:2:1,所以8min后三种物质的浓度应为:(0.060.01)mol/L、(0.120.02)mol/L、(0.04+0.01)mol/L,而8min后氢气的浓度为0.2mol/L,所以多加了0.1mol/L×10L=1mol的氢气;
第8min时反应的浓度商Qc=![]() =
=![]() =25≠K,
=25≠K,
所以此时不是平衡状态,
故答案为:增加了1mol氢气;不是;
③从反应限度角度考虑:该反应为放热反应,温度过高,转化率降低;从速率角度考虑:温度低,反应速率慢,单位时间内的产量低,为提高经济效应,反应速率和限度应兼顾,所以选择温度一般控制在240270℃;
故答案为:温度低,反应速率慢,单位时间内的产量低;而该反应为放热反应,温度过高,转化率降低;
(3)20.00mL0.1000molL1NaOH溶液与等体积、等浓度甲酸溶液混合后,恰好生成甲酸钠,甲酸钠溶液因为甲酸根的水解显碱性,离子方程式为:HCOO﹣+H2OHCOOH+OH﹣,故答案为:>7;HCOO﹣+H2OHCOOH+OH﹣。

【题目】根据下列五种元素的电离能数据![]() 单位:
单位:![]() ,它们的最高价氧化物对应的水化物中,碱性最弱的是( )
,它们的最高价氧化物对应的水化物中,碱性最弱的是( )
元素代号 |
|
|
|
|
A | 420 | 3100 | 4400 | 5900 |
B | 500 | 4600 | 6900 | 9500 |
C | 740 | 1500 | 7700 | 10500 |
D | 580 | 1800 | 2700 | 11600 |
E | 2080 | 4000 | 6100 | 9400 |
A.![]() B.
B.![]() C.
C.![]() D.
D.![]()