【题目】NO、NO2是汽车尾气中主要的含氮氧化物。回答下列问题:
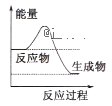
(1)已知氮氧化物转化过程中的能量变化如图(图中表示生成2molNO2的能量变化)。1molNO氧化为NO2的焓变ΔH=___。

(2)某温度下,反应的平衡常数如下:
a.2NO2(g)N2(g)+2O2(g) K=6.7×1016
b.2NO(g)N2(g)+O2(g) K=2.2×1030
分解反应趋势较大的反应是___(填“a”或“b”);反应2NO(g)+O2(g)2NO2(g)的K=___(保留三位有效数字)。
(3)已知反应2NO(g)+O2(g)2NO2的正反应速率v正=k1cm(NO)cn(O2),其中k为速率常数,可通过下列实验数据计算k、m、n。
起始浓度/molL-1 | |||
组别 | NO | O2 | 初始速率 /molL-1s-1 |
1 | 0.02 | 0.0125 | 7.98×10-3 |
2 | 0.02 | 0.0250 | 15.96×10-3 |
3 | 0.04 | 0 0125 | 31.92×10-3 |
则k1=___,m=___,n=___。
(4)已知该反应的历程为:
第一步:NO+NO![]() N2O2 快速平衡
N2O2 快速平衡
第二步:N2O2+O2![]() 2NO2 慢反应
2NO2 慢反应
其中可近似认为第二步反应不影响第一步的平衡,第一步反应中:v(正)=k1c2(NO),v(逆)=k-1c(N2O2)。下列叙述正确的是___(填字母)。
A.第一步反应的平衡常数K=![]()
B.v(第一步的正反应)<v(第一步的反应)
C.第二步的活化能比第一步的活化能高
D.第二步中N2O2与O2的碰撞100%有效
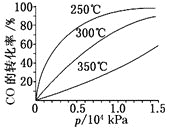
(5)一定条件下测得容器中NO、O2、NO2浓度发生如图变化。

①NO的平衡转化率为___。
②该温度下反应2NO(g)+O2(g)2NO2(g)的平衡常数为___(保留整数)。
【题目】硫代硫酸钠晶体(Na2S2O35H2O,M=248g/mol)是一种重要的化工产品。某兴趣小组拟制备硫代硫酸钠晶体,具体流程如图:

回答下列问题:
(1)吸硫装置如图所示。装置B的作用是检验装置A中SO2的吸收效率,表明SO2吸收效率低的实验现象是_____。

(2)市售硫代硫酸钠中常含有硫酸钠杂质,选用下列试剂设计实验方案进行检验:试剂:稀盐酸、稀H2SO4、BaCl2溶液、Na2CO3溶液、H2O2溶液、无氧蒸镏水,完成下列操作:
实验操作 | 现象 | 结论 |
取少量样品于试管中,加入无氧蒸馏水 | 固体完全溶解 | |
往试管中加入_____ | _______,有刺激性气体产生 | 试样中含有硫代硫酸钠 |
静置,取上层清液,滴加_______ | ______________ | 试样含有硫酸根 |
(3)测定硫代硫酸钠的纯度步骤如下:
①溶液配制:准确取5.0000g产品,配制成250mL溶液,配制溶液的蒸馏水必须经过煮沸、冷却后才能使用,其目的是杀菌、除_____及二氧化碳。
②滴定:向锥形瓶中加入25.00mL0.01mol/LKIO3溶液,加入过量KI溶液和H2SO4溶液,发生反应:IO3-+5I-+6H+ =3I2+3H2O,然后加入淀粉作指示剂,用硫代硫酸钠样品溶液滴定,发生反应:I2+2S2O32-=S4O62-+2I-。当_____,即为终点。消耗样品溶液的用量为20.00mL,则样品纯度为_____%(保留4位有效数字)。