题目内容
【题目】(1)O3将I-氧化成I2的过程由3步反应组成:
①I-(aq)+O3(g)=IO-(aq)+O2(g) △H1
②IO-(aq)+H+(aq)![]() HOI(aq) △H2
HOI(aq) △H2
③HOI(aq)+I-(aq)+H+(aq)![]() I2(aq)+H2O(l) △H3
I2(aq)+H2O(l) △H3
总反应的热化学方程式为___。
(2)AgCl和水的悬浊液中加入足量的Na2S溶液并振荡,结果白色固体完全转化为黑色固体:写出白色固体转化成黑色固体的化学方程式:___。
(3)向Na2CO3溶液中滴加酚酞呈红色的原因是___(用离子方程式表示);溶液中各离子浓度由大到小的顺序___;向此溶液中加入AlCl3溶液,观察到的现象是__,反应的离子方程式为___。
【答案】2I-(aq)+O3(g)+2H+(aq)![]() I2(aq)+O2(g)+H2O(l) △H=△H1+△H2+△H3 2AgCl+Na2S=Ag2S+2NaCl CO32-+H2O
I2(aq)+O2(g)+H2O(l) △H=△H1+△H2+△H3 2AgCl+Na2S=Ag2S+2NaCl CO32-+H2O![]() HCO3-+OH- c(Na +)>c(CO 3 2 -)>c(OH -)>c(HCO 3 -)>c(H + ) 产生气泡及白色沉淀,溶液红色逐渐变浅至颜色消失 2Al3+ + 3CO32- + 3H2O=2Al(OH)3↓ + 3CO2↑
HCO3-+OH- c(Na +)>c(CO 3 2 -)>c(OH -)>c(HCO 3 -)>c(H + ) 产生气泡及白色沉淀,溶液红色逐渐变浅至颜色消失 2Al3+ + 3CO32- + 3H2O=2Al(OH)3↓ + 3CO2↑
【解析】
(1)将所给的三个反应:①+②+③可得总反应:2I-(aq)+O3(g)+2H+(aq)I2(aq)+O2(g)+H2O(l),△H=△H1+△H2+△H3。
故答案为 2I-(aq)+O3(g)+2H+(aq)I2(aq)+O2(g)+H2O(l) △H=△H1+△H2+△H3
(2)硫化银的溶解度比氯化银还小,根据沉淀转化的原理,氯化银可以和硫离子反应生成硫化银,反应化学方程式为:2AgCl+Na2S=Ag2S+2NaCl
故答案为 2AgCl+Na2S=Ag2S+2NaCl
(3)Na2CO3为强碱弱酸盐,水解呈碱性,在溶液中存在CO32-+H2OHCO3-+OH-,钠离子浓度大于碳酸根离子浓度的2倍,且溶液呈碱性,故氢离子浓度最低,故各离子浓度由大到小的顺序c(Na +)>c(CO 3 2 -)>c(OH -)>c(HCO 3 -)>c(H + )。加入铝离子后,CO32-与Al3+反应会双水解,产生气泡及白色沉淀,溶液红色逐渐变浅至颜色消失,反应离子方程式为2Al3+ + 3CO32- + 3H2O=2Al(OH)3↓ + 3CO2↑。
故答案为 CO32-+H2OHCO3-+OH- c(Na +)>c(CO 3 2 -)>c(OH -)>c(HCO 3 -)>c(H + ) 产生气泡及白色沉淀,溶液红色逐渐变浅至颜色消失 2Al3+ + 3CO32- + 3H2O=2Al(OH)3↓ + 3CO2↑

 阅读快车系列答案
阅读快车系列答案【题目】尿素[CO(NH2)2]是含氮量最高的氮肥。
(1)已知工业上合成尿素的反应分为 如下两步:
第1步:2NH3(1)+CO2(g)![]() H2NCOONH4(1) ΔH1=-330.0kJmol-1
H2NCOONH4(1) ΔH1=-330.0kJmol-1
第2步:H2NCOONH4(1)![]() H2O(1)+CO(NH2)2(1) ΔH2=+226.3kJmol-1
H2O(1)+CO(NH2)2(1) ΔH2=+226.3kJmol-1
则下列各图能正确表示尿素合成过程中能量变化曲线的是___(填字母编号)。
A.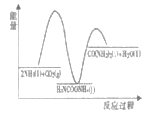 B.
B.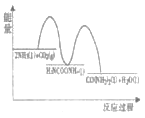
C.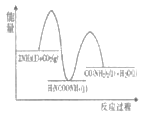 D.
D.
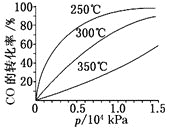
(2)一定条件下工业合成尿素的总反应:CO2(g)+2NH3(g)![]() CO(NH2)2(g)+H2O(g),t℃时,向容积恒定为2L的密闭容器中加入0.20molCO2和0.80molNH3,反应中CO2的物质的量随时间变化如下表所示:
CO(NH2)2(g)+H2O(g),t℃时,向容积恒定为2L的密闭容器中加入0.20molCO2和0.80molNH3,反应中CO2的物质的量随时间变化如下表所示:
时间/min | 0 | 40 | 70 | 80 | 100 |
n(CO2)/mol | 0.20 | 012 | 0.10 | 0.10 | 0.10 |
①前40min内v(NH3)=___,此温度下该反应的平衡常数为___。
②30min时v正(CO2)___80min时v逆(H2O)(选填“>”,“=”或“<”)。
③在100min时,保持其它条件不变,再向容器中充入0.10molCO2和0.40molNH3,重新建立平衡后CO2的转化率与原平衡相比将___(填“增大”、“不变”或“减小”)。
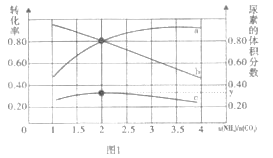
④氨碳比[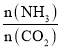 ]对合成尿素有影响,恒温恒容条件下将总物质的量为3mol的NH3和CO2的混合气体按不同的氨碳比进行反应,结果如图1所示。ab线分别表示CO2或NH3的转化率变化,c线表示平衡体系中尿素的体积分数变化[
]对合成尿素有影响,恒温恒容条件下将总物质的量为3mol的NH3和CO2的混合气体按不同的氨碳比进行反应,结果如图1所示。ab线分别表示CO2或NH3的转化率变化,c线表示平衡体系中尿素的体积分数变化[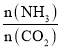 ]=___时,尿素产量最大;经计算,图中y=___(精确到0.01)。
]=___时,尿素产量最大;经计算,图中y=___(精确到0.01)。
(3)工业生产中为提高尿素的产率可采取的措施有___。
(4)近期科学家发现微生物可将生产废水中的尿素直接转化为对环境友好的两种物质,其工作原理如图2所示。回答下列问题:
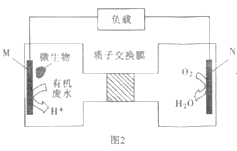
①N极为___板(填“正”或“负”),M电极反应式___。
②N极消耗标准状况下336L气体时,M极理论上处理的尿素的质量为___g。
【题目】以环已醇( ![]() )为原料制取己二酸[HOOC(CH2)4COOH]的实验流程如下:
)为原料制取己二酸[HOOC(CH2)4COOH]的实验流程如下:
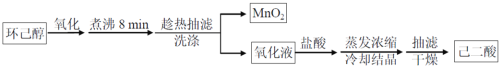
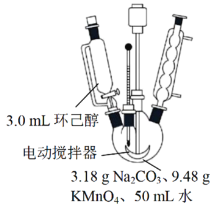
其中“氧化”的实验过程:在250mL四口烧瓶中加入50mL水和3.18g碳酸钠,低速搅拌至碳酸钠溶解,缓慢加入9.48g(约0.060mol)高锰酸钾,按图示搭好装置,打开电动搅拌,加热至35℃,滴加3.2mL(约0.031mol)环己醇,发生的主要反应为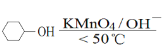 KOOC(CH2)4COOK ΔH<0
KOOC(CH2)4COOK ΔH<0
(1)“氧化”过程应采用___________加热。(填标号)
A.热水浴 B.酒精灯 C.煤气灯 D.电炉
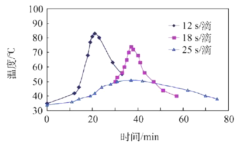
(2)“氧化”过程,不同环己醇滴加速度下,溶液温度随时间变化曲线如图,为保证产品纯度,应选择的滴速为___________s/滴。
(3)为证明“氧化”反应已结束,在滤纸上点1滴混合物,若观察到_____,则表明反应已经完成.
(4)“趁热抽滤”后,用________进行洗涤。
(5)室温下,相关物质溶解度如表。“蒸发浓缩”过程中,为保证产品纯度及产量,应浓缩溶液体积至__(填标号)。
化学式 | 己二酸 | NaCl | KCl |
溶解度g/100g 水 | 1.44 | 35.1 | 33.3 |
A.5mL B. 10mL C. 15mL D. 20mL
(6)称取已二酸(Mr=146g/mol)样品0.2920g,用新煮沸的50mL热水溶解,滴入2滴酚酞试液,用0.2000 mol/LNaOH溶液滴定至终点,进行平行实验及空白实验后,消耗NaOH的平均体积为19.70mL.
①NaOH溶液应装于_______ (填仪器名称).
②己二酸样品的纯度为___________.