题目内容
【题目】硫代硫酸钠晶体(Na2S2O35H2O,M=248g/mol)是一种重要的化工产品。某兴趣小组拟制备硫代硫酸钠晶体,具体流程如图:
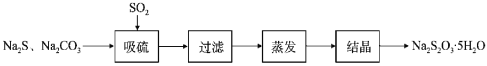
回答下列问题:
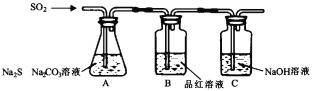
(1)吸硫装置如图所示。装置B的作用是检验装置A中SO2的吸收效率,表明SO2吸收效率低的实验现象是_____。
(2)市售硫代硫酸钠中常含有硫酸钠杂质,选用下列试剂设计实验方案进行检验:试剂:稀盐酸、稀H2SO4、BaCl2溶液、Na2CO3溶液、H2O2溶液、无氧蒸镏水,完成下列操作:
实验操作 | 现象 | 结论 |
取少量样品于试管中,加入无氧蒸馏水 | 固体完全溶解 | |
往试管中加入_____ | _______,有刺激性气体产生 | 试样中含有硫代硫酸钠 |
静置,取上层清液,滴加_______ | ______________ | 试样含有硫酸根 |
(3)测定硫代硫酸钠的纯度步骤如下:
①溶液配制:准确取5.0000g产品,配制成250mL溶液,配制溶液的蒸馏水必须经过煮沸、冷却后才能使用,其目的是杀菌、除_____及二氧化碳。
②滴定:向锥形瓶中加入25.00mL0.01mol/LKIO3溶液,加入过量KI溶液和H2SO4溶液,发生反应:IO3-+5I-+6H+ =3I2+3H2O,然后加入淀粉作指示剂,用硫代硫酸钠样品溶液滴定,发生反应:I2+2S2O32-=S4O62-+2I-。当_____,即为终点。消耗样品溶液的用量为20.00mL,则样品纯度为_____%(保留4位有效数字)。
【答案】溶液颜色很快褪色或红色很快褪去 过量稀盐酸 溶液产生黄色浑浊 BaCl2溶液 产生白色沉淀 水中溶解的氧气 加入最后一滴样品溶液时,溶液由蓝色变为无色,并且半分钟内不变色 93.00
【解析】
(1)根据SO2的漂白性检验SO2的吸收率;
(2)①根据Na2S2O3与强酸反应产生难溶于水的S单质检验Na2S2O3的存在;
②利用BaSO4是白色不溶于水,也不溶于酸的性质检验SO42-的存在;
(3)水中溶解氧气会消耗Na2S2O3,影响Na2S2O3纯度的测定;
根据I2遇淀粉溶液变为蓝色判断滴定终点;利用物质反应时微粒的物质的量关系,由KIO3溶液中溶质的物质的量计算反应产生的I2的物质的量,再结合I2+2S2O32-=S4O62-+2I-中反应关系可确定20 mL样品溶液中Na2S2O3物质的量,进而得到Na2S2O3纯度。
(1)酸性H2SO3>H2CO3>H2S,所以向含有Na2S、Na2CO3的混合溶液中通入SO2气体,SO2气体发生反应产生H2S、CO2气体而消耗SO2,由于SO2具有漂白性,所以要检验SO2的吸收效率降低,则有SO2气体会由导气管进入到盛有品红溶液的B装置,会看到溶液颜色很快褪色或红色很快褪去;
(2)硫代硫酸钠固体用无氧蒸馏水溶解后,得到其溶液,向该溶液中加入过量稀盐酸,发生反应:2HCl+Na2S2O3=2NaCl+S↓+SO2↑+H2O,因此会看到溶液变浑浊,就可以证明试样中含有硫代硫酸钠;
静置,取上层清液,滴加BaCl2溶液,若产生白色沉淀,证明发生了反应:Ba2++SO42-=BaSO4↓;
(3)①配制Na2S2O3溶液时,为了防止溶解在溶液中的O2反应消耗Na2S2O3,而影响其纯度的测量,蒸馏水必须经过煮沸、冷却后才能使用,其目的是杀菌、除水中溶解的氧气及二氧化碳。
②25.00 mL0.01 mol/LKIO3溶液中KIO3的物质的量n(KIO3)=c·V=0.01 mol/L×0.025 L=2.5×10-4 mol,根据方程式:IO3-+5I-+6H+ =3I2+3H2O可知反应产生I2的物质的量n(I2)=3n(KIO3)= 7.5×10-4mol,以淀粉作指示剂,用Na2S2O3溶液滴定溶液中的I2单质,当溶液中I2恰好消耗完全时,溶液由蓝色变为无色,半分钟内不变色就达到滴定终点。当达到滴定终点时,消耗硫代硫酸钠样品溶液20.00mL,其中含有Na2S2O3的物质的量为n(Na2S2O3)=2n(Na2S2O3)=2×7.5×10-4 mol=1.5×10-3 mol,250 mL溶液中含有Na2S2O3的物质的量n(Na2S2O3)=1.5×10-3 mol×![]() =1.875×10-2 mol,其中含有的Na2S2O3的质量为m(Na2S2O35H2O)=1.875×10-2 mol×248g/mol=4.65 g,所以样品纯度为
=1.875×10-2 mol,其中含有的Na2S2O3的质量为m(Na2S2O35H2O)=1.875×10-2 mol×248g/mol=4.65 g,所以样品纯度为![]() ×100%=93.00%。
×100%=93.00%。

【题目】NO、NO2是汽车尾气中主要的含氮氧化物。回答下列问题:
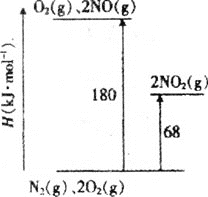
(1)已知氮氧化物转化过程中的能量变化如图(图中表示生成2molNO2的能量变化)。1molNO氧化为NO2的焓变ΔH=___。
(2)某温度下,反应的平衡常数如下:
a.2NO2(g)N2(g)+2O2(g) K=6.7×1016
b.2NO(g)N2(g)+O2(g) K=2.2×1030
分解反应趋势较大的反应是___(填“a”或“b”);反应2NO(g)+O2(g)2NO2(g)的K=___(保留三位有效数字)。
(3)已知反应2NO(g)+O2(g)2NO2的正反应速率v正=k1cm(NO)cn(O2),其中k为速率常数,可通过下列实验数据计算k、m、n。
起始浓度/molL-1 | |||
组别 | NO | O2 | 初始速率 /molL-1s-1 |
1 | 0.02 | 0.0125 | 7.98×10-3 |
2 | 0.02 | 0.0250 | 15.96×10-3 |
3 | 0.04 | 0 0125 | 31.92×10-3 |
则k1=___,m=___,n=___。
(4)已知该反应的历程为:
第一步:NO+NO![]() N2O2 快速平衡
N2O2 快速平衡
第二步:N2O2+O2![]() 2NO2 慢反应
2NO2 慢反应
其中可近似认为第二步反应不影响第一步的平衡,第一步反应中:v(正)=k1c2(NO),v(逆)=k-1c(N2O2)。下列叙述正确的是___(填字母)。
A.第一步反应的平衡常数K=![]()
B.v(第一步的正反应)<v(第一步的反应)
C.第二步的活化能比第一步的活化能高
D.第二步中N2O2与O2的碰撞100%有效
(5)一定条件下测得容器中NO、O2、NO2浓度发生如图变化。
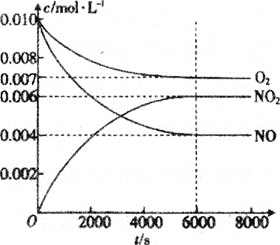
①NO的平衡转化率为___。
②该温度下反应2NO(g)+O2(g)2NO2(g)的平衡常数为___(保留整数)。