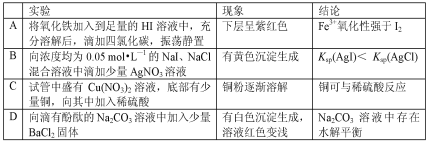
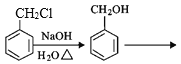
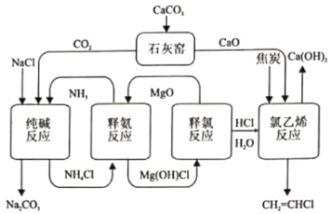
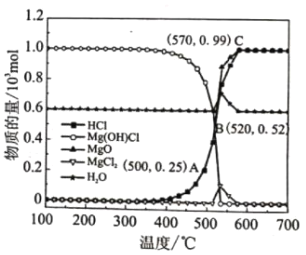
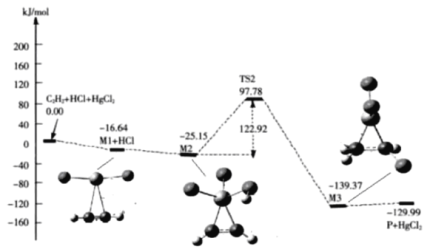
题目内容
【题目】化学反应中的能量变化是人类获取能量的重要途径。
(1)液化气是一种重要的家庭燃料,下列示意图与液化气在燃烧过程中的能量变化最相符的是___
A.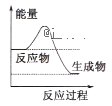 B.
B. C.
C.
(2)人们普遍使用的干电池工作时是将化学能转化为___。
(3)已知拆开1molH2中的化学键要吸收436kJ的能量,拆开1molO2中的化学键要吸收496kJ的能量,形成水分子中的1molH—O键要放出463 kJ的能量,试计算2H2+O2=2H2O反应中的ΔH=___kJ·mol-1。
(4)依据氧化还原反应:2Ag+(aq)+Cu(s)=Cu2+(aq)+2Ag(s)设计的原电池如图所示。请回答下列问题:

①电极X的材料是___;电解质溶液Y是___;
②银电极为电池的___极,发生的电极反应为___;X电极上发生的电极反应为___;
③如果闭合电路前X电极与银电极质量相等,当电路中通过0.1mol电子时,两电极质量差为___g。(原子量Cu:64;Ag:108)
【答案】A 电能 -484 铜 硝酸银溶液 正 Ag++e-=Ag Cu-2e-=Cu2+ 14
【解析】
原电池是由两个半电池组成的,根据电池反应式2Ag+(aq)+Cu(s)=Cu2+(aq)+2Ag(s) 判断,铜是负极,银是正极,负极上铜失电子发生氧化反应,正极上银离子得电子发生还原反应,则铜极应处于含有铜离子的可溶性盐溶液中,银处于含有银离子的可溶性银盐溶液中,电子从负极沿导线流向正极。根据此分析进行解答。
(1)液化气燃烧是放热反应,反应物总能量应该高于生成物总能量,故答案选A。
故答案为A。
(2)人们普遍使用的干电池工作时是利用了原电池原理,将化学能转化为电能。
故答案为 电能
(3)2H2+O2=2H2O反应中2molH2中的化学键断裂要吸收436kJ×2=872KJ能量,1mol O2中的化学键断裂吸收496kJ能量,2molH2O中含有4molH-O键,故成键放出463×4KJ=1852KJ的能量,故放出的能量=1852-496-872=484kJ,故ΔH= - 484 kJ·mol-1
故答案为 -484
(4)①铜是负极,银是正极,X为铜极应处于含有铜离子的可溶性盐溶液中,银处于含有银离子的可溶性银盐溶液中,Y是可溶性银盐溶液,为硝酸银溶液。
②银是正极,正极上银离子得电子发生还原反应,电极反应式为:Ag++e-=Ag。X极为负极发生氧化反应,负极反应为Cu-2e-=Cu2+。
③由银电极反应式为:Ag++e-=Ag可知通过0.1mol电子时生成银的质量为0.1×108=10.8g,负极铜电极反应为Cu-2e-=Cu2+,通过0.1mol电子消耗铜的质量为0.1×0.5×64=3.2g,故两电极质量差为10.8+3.2g=14g。
故答案为 铜 硝酸银溶液 正 Ag++e-=Ag Cu-2e-=Cu2+ 14

【题目】实验室用环己醇脱水的方法合成环己烯,该实验的装置如图所示:
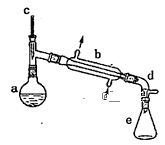
可能用到的有关数据如下:
相对分子质量 | 密度/(g·cm-3) | 沸点/℃ | 溶解性 | |
环已醇 | 100 | 0.9618 | 161 | 微溶于水 |
环已烯 | 82 | 0.8102 | 83 | 难溶于水 |
按下列实验步骤回答问题:
Ⅰ.产物合成
在a中加入10.0g环己醇和2片碎瓷片,冷却搅拌下慢慢加入1mL浓硫酸,b中通入冷却水后,开始缓慢加热a,控制馏出物的温度接近90℃。
(l)碎瓷片的作用是__;
(2)a中发生主要反应的化学方程式为___;本实验最容易产生的有机副产物的结构简式为__。
Ⅱ.分离提纯
将反应粗产物倒入分液漏斗中,依次用少量5%碳酸钠溶液和水洗涤,分离后加入无水氯化钙颗粒,静置一段时间后弃去氯化钙,最终通过操作X得到纯净的环己烯,称量,其质量为4.1g。
Ⅲ.产物分析及产率计算
(3)①核磁共振氢谱可以帮助鉴定产物是否为环己烯,环己烯分子中有___种不同化学环境的氢原子。
②本实验所得环己烯的产率是___。
【题目】实验室用乙醇、浓磷酸和溴化钠反应来制备溴乙烷,其反应原理和实验的装置如下(反应需要加热,图中省去了加热装置):
H3PO4(浓)+NaBr![]() NaH2PO4+HBr、CH3CH2OH+HBr
NaH2PO4+HBr、CH3CH2OH+HBr![]() CH3CH2Br+H2O
CH3CH2Br+H2O
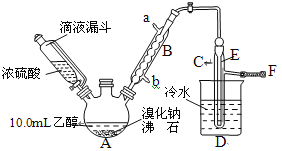
有关数据见下表:
乙醇 | 溴乙烷 | 溴 | |
状态 | 无色液体 | 无色液体 | 深红色液体 |
密度g/mL | 0.79 | 1.44 | 3.1 |
沸点/℃ | 78.5 | 38.4 | 59 |
(1)A中放入沸石的作用是___。
(2)仪器B的名称为___,B中进水口为___(填“a”或“b”)口。
(3)实验中用滴液漏斗代替分液漏斗的优点为:___。
(4)制取氢溴酸时,为什么不能用浓H2SO4代替浓磷酸?___(用化学方程式表示)。
(5)将C中的馏出液转入三角烧瓶中,边振荡边逐滴滴入浓H2SO4以除去水等杂质,滴加浓硫酸约1~2mL,使溶液明显分层,再用分液漏斗分去硫酸层,将经硫酸处理后的溴乙烷转入蒸馏瓶,水浴加热蒸馏,收集到35~40℃馏分约10.0g,从乙醇的角度考虑,本实验所得溴乙烷的产率是___。