题目内容
【题目】研究NO2、SO2、CO等大气污染气体的处理具有重要意义。
(1)NO2可用水吸收,相应的化学反应方程式为___。利用反应6NO2+8NH3![]() 7N2+12H2O也可处理NO2。当转移1.2mol电子时,消耗的NO2在标准状况下是___L。
7N2+12H2O也可处理NO2。当转移1.2mol电子时,消耗的NO2在标准状况下是___L。
(2)已知:2SO2(g)+O2(g)![]() 2SO3(g) ΔH=-196.6kJ/mol;2NO(g)+O2(g)
2SO3(g) ΔH=-196.6kJ/mol;2NO(g)+O2(g)![]() 2NO2(g) ΔH=-113.0kJ/mol;
2NO2(g) ΔH=-113.0kJ/mol;
①则反应NO2(g)+SO2(g)![]() SO3(g)+NO(g) ΔH的ΔH=___kJ/mol。
SO3(g)+NO(g) ΔH的ΔH=___kJ/mol。
②一定条件下,将NO2与SO2以体积比1:2置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是___。
A.体系压强保持不变
B.混合气体颜色保持不变
C.SO3和NO的体积比保持不变
D.每消耗1molSO3的同时生成1molNO2
③测得上述反应平衡时NO2与SO2的体积比为1:6,则平衡常数K=___。
(3)CO可用于合成甲醇,反应方程式为CO(g)+2H2(g)![]() CH3OH(g),ΔH。CO在不同温度下的平衡转化率与压强的关系如图所示。
CH3OH(g),ΔH。CO在不同温度下的平衡转化率与压强的关系如图所示。
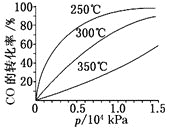
该反应ΔH___0(填“>”或“<”)。实际生产条件控制在250℃、1.3×104kPa左右,选择此压强的理由是___。
【答案】3NO2+H2O=2HNO3+NO 6.72 -41.8 B ![]() < 在1.3×104kPa下,CO的转化率已较高,再增大压强,CO的转化率提高不大,而生产成本增加,得不偿失
< 在1.3×104kPa下,CO的转化率已较高,再增大压强,CO的转化率提高不大,而生产成本增加,得不偿失
【解析】
(1)根据化合价的变化结合方程式计算;
(2)利用盖斯定律计算反应热,达到平衡状态时,正逆反应速率相等,各物质的浓度不变,由此衍生的一些物理量也不变,计算平衡时各物质的浓度,可计算平衡常数;
(3)从横坐标上一点,画一条平行于纵坐标的虚线,看相同压强下不同温度时CO的平衡转化率,温度越低转化率越低,说明,升温时平衡向逆向移动.
![]() 溶于水时,与水反应生成硝酸和一氧化氮,相应的化学反应方程式为:
溶于水时,与水反应生成硝酸和一氧化氮,相应的化学反应方程式为:![]() ;反应
;反应![]() 中,
中,![]() 中N元素化合价降低,由
中N元素化合价降低,由![]() 价降低到0价,则
价降低到0价,则![]() 参加反应,转移24mol电子,所以当转移
参加反应,转移24mol电子,所以当转移![]() 电子时,消耗
电子时,消耗![]() 为
为![]() ,标准状况下的体积为
,标准状况下的体积为![]() ,
,
故答案为:![]() ;
;
![]() 已知:
已知:![]()
![]()
![]()
![]()
![]()
![]() ,利用盖斯定律将
,利用盖斯定律将![]() 得
得
![]()
![]()
![]() ;故答案为:
;故答案为:![]() ;
;
![]() 反应前后气体体积相等,无论是否达到平衡,体系压强都保持不变,不能用于判断是否达到平衡状态,故A错误;
反应前后气体体积相等,无论是否达到平衡,体系压强都保持不变,不能用于判断是否达到平衡状态,故A错误;
B.混合气体颜色保持不变,说明![]() 的浓度不变,达到平衡状态,故B正确;
的浓度不变,达到平衡状态,故B正确;
C.![]() 和NO的计量数之比为1:1,无论是否达到平衡,二者的体积比保持不变,不能判断是否达到平衡状态,故C错误;
和NO的计量数之比为1:1,无论是否达到平衡,二者的体积比保持不变,不能判断是否达到平衡状态,故C错误;
D.物质的量之比等于化学计量数之比,则每消耗1molSO3的同时生成![]() ,反应速率同向,不能判断是否达到平衡状态,故D错误
,反应速率同向,不能判断是否达到平衡状态,故D错误![]()
故选:B;
![]() 设起始
设起始![]() 的体积为a,则
的体积为a,则![]() 的体积为2a,平衡时生成的NO的体积为x,
的体积为2a,平衡时生成的NO的体积为x,
![]()
![]()
![]()
起始物质的体积 a 2a 0 0
转化物质的体积 x x x x
平衡物质的体积 ![]()
![]() x x
x x
平衡时![]() 与
与![]() 体积比为1:6,即
体积比为1:6,即![]() :
:![]() :6,故
:6,故![]() ,故平衡常数
,故平衡常数![]() ,
,
故答案为:![]() ;B;
;B;![]() ;
;
![]() 由图可知,温度升高,CO的转化率降低,平衡向逆反应方向移动,故逆反应是吸热反应,正反应是放热反应,
由图可知,温度升高,CO的转化率降低,平衡向逆反应方向移动,故逆反应是吸热反应,正反应是放热反应,![]() ;压强大,有利于加快反应速率,有利于使平衡正向移动,但压强过大,需要的动力大,对设备的要求也高,故选择
;压强大,有利于加快反应速率,有利于使平衡正向移动,但压强过大,需要的动力大,对设备的要求也高,故选择![]() 、
、![]() 左右的条件,因为在
左右的条件,因为在![]() 、压强为
、压强为![]() 时,CO的转化率已较大,再增大压强,CO的转化率变化不大,没有必要再增大压强,
时,CO的转化率已较大,再增大压强,CO的转化率变化不大,没有必要再增大压强,
故答案为:![]() ;在
;在![]() 下,CO的转化率已较高,再增大压强,CO的转化率提高不大,而生产成本增加,得不偿失。
下,CO的转化率已较高,再增大压强,CO的转化率提高不大,而生产成本增加,得不偿失。

 目标测试系列答案
目标测试系列答案【题目】磷酸是重要的化学试剂和工业原料。请回答下列问题:
(1)已知:25℃时,磷酸和氢氟酸的电离常数如下表所示。
物质 | H3PO4 | HF |
电离常数 | Ka1=7.1×10-3;Ka2=6.3×10-8;Ka3=4.2×10-13 | Ka=6.6×10-4 |
向NaF溶液中滴加少量H3PO4溶液,反应的离子方程式为___。
(2)已知:Ⅰ.CaO(s)+H2SO4(l)CaSO4(s)+H2O(l) ΔH=-271kJmol-1
Ⅱ.5CaO(s)+3H3PO4(l)+HF(g)Ca5(PO4)3F(s)+5H2O(l) ΔH=-937kJmol-1
则:①工业上用Ca5(PO4)3F和硫酸反应制备磷酸的热化学方程式为___。
②一定条件下,在密闭容器中只发生反应Ⅱ,达到平衡后缩小容器容积,HF的平衡转化率___(填“增大”“减小”或“不变”,下同);HF的平衡浓度___。
(3)工业上用磷尾矿制备Ca5(PO4)3F时生成的副产物CO可用于制备H2,原理为CO(g)+H2O(g)CO2(g)+H2(g) ΔH。
①一定温度下,向10L密闭容器中充入0.5molCO和1molH2O(g),2min达到平衡时,测得0~2min内用CO2表示的反应速率v(CO2)=0.02molL-1min-1。则CO的平衡转化率α=___;该反应的平衡常数K=___。
②在压强不变的密闭容器中发生上述反应,设起始的(![]() )=y,CO的平衡体积分数(φ)与温度(T)的关系如图所示。则:该反应的ΔH___0(填“>”“<”或“=”,下同)。a___1,理由为___。
)=y,CO的平衡体积分数(φ)与温度(T)的关系如图所示。则:该反应的ΔH___0(填“>”“<”或“=”,下同)。a___1,理由为___。

【题目】室温下,下列有关两种溶液的说法不正确的是
序号 | ① | ② |
pH | 12 | 12 |
溶液 | 氨水 | 氢氧化钠溶液 |
A.①②两溶液中c(OH-)相等
B.①溶液的物质的量浓度为0.01mol·L-1
C.①②两溶液分别加水稀释10倍,稀释后溶液的pH:①>②
D.等体积的①②两溶液分别与0.01 mol·L-1的盐酸完全中和,消耗盐酸的体积:①>②

