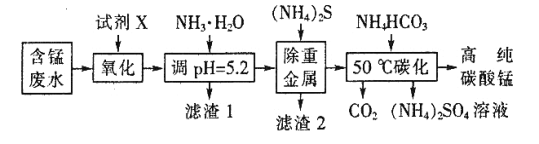
【题目】高纯碳酸锰(MnCO3)广泛应用于电子行业,制造高性能磁性材料。工业利用含锰废水(主要含Mn2+、![]() 、H+、Fe2+、Al3+、Cu2+)制备碳酸锰、回收硫酸铵的工艺流程如下:
、H+、Fe2+、Al3+、Cu2+)制备碳酸锰、回收硫酸铵的工艺流程如下:
已知某些物质完全沉淀的pH值如表:
沉淀物 | Fe(OH)3 | Al(OH)3 | Cu(OH)2 | Mn(OH)2 | CuS | MnS | MnCO3 |
沉淀完全时的pH | 3.7 | 5.2 | 6.4 | 9.8 | ≥0 | ≥7 | ≥7 |
回答下列问题:
(1)试剂X是___________ (填标号)。
a.Cl2 b.MnO2 c.浓HNO3 d.H2O2
(2)“滤渣1”中主要成分的化学式为__________。
(3)“除重金属”时发生反应的离子方程式是______;反应中使用(NH4)2S而不使用Na2S的原因是________。
(4)“50℃碳化”得到高纯碳酸锰,反应的离子方程式为_____,反应中通常需加入稍过量的NH4HCO3,且控制溶液的pH为6.8~7.4,加入稍过量的NH4HCO3的目的是______使MnCO3沉淀完全,溶液的pH不能过低的原因是_____。
(5)由 MnCO3可制得重要的催化剂MnO2,2MnCO3+O2=2MnO2+2CO2。现在空气中加热460.0g的MnCO3,得到332.0g产品,若产品中杂质只有MnO,则该产品MnO2的质量分数是___________。