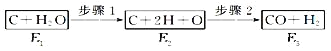��Ŀ����
����Ŀ����ͼΪ���־������ʾ��ͼ��
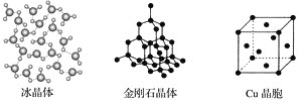
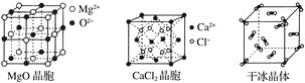
��ش��������⣺
��1�����������У�����֮���Թ��ۼ�����γɵľ�����____��
��2���������ʯ��MgO��CaCl2���ɱ�5�־�����۵��ɸߵ��͵�˳��Ϊ��___��
��3��NaCl������MgO������ͬ��NaCl����ľ�����___(����ڡ���С�ڡ�)MgO���壬ԭ����____��
��4��ÿ��Cu������ʵ��ռ��___��Cuԭ�ӣ�CaCl2������Ca2������λ��Ϊ__��
��5�������۵�Զ���ڸɱ�����H2O�Ǽ��Է��ӡ�CO2�ǷǼ��Է����⣬����һ����Ҫ��ԭ����_____��
���𰸡����ʯ ���ʯ��MgO��CaCl2�������ɱ� С�� MgO���������ӵĵ��������NaCl���������ӵ��������r(Mg2+)��r(Na+)��r(O2-)��r(Cl-) 4 8 ˮ����֮���γ��⽡
��������
(1)ԭ�Ӿ�����ԭ�Ӽ��Թ��ۼ���ϣ�
(2)�۵��һ����ɣ�ԭ�Ӿ��壾���Ӿ��壾���Ӿ��壬ͬ�־�������������������С�Ƚϣ�
(3)���Ӱ뾶ԽС�����Ӵ����Խ�࣬������Խ��
(4)���ݾ�̯�����㣻
(5)���Ӽ京�����ʱ�����۷е�ϸߡ�
(1)ԭ�Ӿ�����ԭ�Ӽ��Թ��ۼ���ϣ�������֮���Թ��ۼ�����γɵľ����ǽ��ʯ���ʴ�Ϊ�����ʯ��
(2)�۵��һ����ɣ�ԭ�Ӿ��壾���Ӿ��壾���Ӿ��壬���ɱ����ڷ��Ӿ��壬�۵㣺�����ɱ���MgO��CaCl2�������Ӿ��壬�۵㣺MgO��CaCl2�����ʯ��ԭ�Ӿ��壬���۵��ɸߵ��͵�˳��Ϊ�����ʯ��MgO��CaCl2�������ɱ����ʴ�Ϊ�����ʯ��MgO��CaCl2�������ɱ���
(3)��ΪMgO�����Ӵ�������ɣ�NaCl�����Ӵ�һ����ɣ����������Ӱ뾶С�������ӣ�þ���Ӱ뾶С�������Ӱ뾶�����Ӱ뾶ԽС�������������Խ�࣬������Խ��NaCl����ľ�����С��MgO����ľ����ܣ��ʴ�Ϊ��С�ڣ�MgO���������ӵĵ��������NaCl���������ӵ��������r(Mg2+)��r(Na+)��r(O2-)��r(Cl-)��
(4)Cuԭ��ռ�����ĺͶ��㣬��ÿ��Cu������ʵ��ռ�е�ԭ����Ϊ![]() ��8+
��8+![]() ��6=4�������Ȼ��Ƶľ���ͼ��֪��ÿ��Ca2+��Χ��8��Cl-����ÿ��Cl-��Χ��4��Ca2+������CaCl2������Ca2+����λ��Ϊ8���ʴ�Ϊ��4��8��
��6=4�������Ȼ��Ƶľ���ͼ��֪��ÿ��Ca2+��Χ��8��Cl-����ÿ��Cl-��Χ��4��Ca2+������CaCl2������Ca2+����λ��Ϊ8���ʴ�Ϊ��4��8��
(5)�����۵�Զ���ڸɱ�����H2O�Ǽ��Է��ӡ�CO2�ǷǼ��Է����⣬ˮ���Ӽ京���������������������ڷ��»������������۷е�ϸߣ��ʴ�Ϊ��H2O����֮�����γ������

 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�