题目内容
【题目】某学生为探究AgCl沉淀的溶解和转化,设计实验方案并记录如下
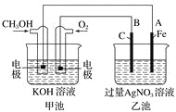
Ⅰ.将等体积等浓度的AgNO3溶液和NaCl溶液混合得到浊液W,过滤,得到滤液X和白色沉淀Y
Ⅱ.向滤液X中滴加几滴饱和Na2S溶液 出现浑浊
Ⅲ.取少量白色沉淀Y,滴加几滴饱和Na2S溶液 沉淀变为黑色
Ⅳ.取少量白色沉淀Y,滴加几滴浓氨水 沉淀逐渐溶解
(1)步骤Ⅰ的浊液W中存在的沉淀溶解平衡为_______________;
(2)由步骤Ⅱ的浑浊可推测,滤液X中除了含有Na+、NO3﹣,还含有的离子有_______________;
(3)能说明步骤Ⅲ中沉淀变黑的离子方程式为____________.沉淀转化的主要原因是_____________;
(4)已知:Ag++2NH3H2O===Ag(NH3)2++2H2O,用平衡移动原理解释步骤Ⅳ中加入浓氨水沉淀逐渐溶解的原因______________;
【答案】AgCl![]() Ag++Cl- Ag+、Cl- 2AgCl(s)+S2-=Ag2S(s)+Cl-(aq) 该温度下硫化银比氯化银溶解度小 AgCl
Ag++Cl- Ag+、Cl- 2AgCl(s)+S2-=Ag2S(s)+Cl-(aq) 该温度下硫化银比氯化银溶解度小 AgCl![]() Ag++Cl-银离子与氨水结合,降低看溶液中的银离子浓度,使上述平衡正向移动,使氯化银溶解
Ag++Cl-银离子与氨水结合,降低看溶液中的银离子浓度,使上述平衡正向移动,使氯化银溶解
【解析】
(1)AgNO3溶液和NaCl溶液混合得到浊液是氯化银沉淀,沉淀溶解平衡为:AgCl![]() Ag++Cl-。
Ag++Cl-。
(2)氯化银存在AgCl![]() Ag++Cl-沉淀溶解平衡,故溶液中还含有Ag+、Cl-。
Ag++Cl-沉淀溶解平衡,故溶液中还含有Ag+、Cl-。
(3)步骤Ⅲ中沉淀变黑是因为该温度下硫化银比氯化银溶解度小,氯化银沉淀转变成硫化银沉淀,2AgCl(s)+S2-=Ag2S(s)+Cl-(aq);
(4)步骤Ⅳ中加入浓氨水沉淀逐渐溶解的原因是AgCl![]() Ag++Cl-银离子与氨水结合,降低看溶液中的银离子浓度,使上述平衡正向移动,使氯化银溶解。
Ag++Cl-银离子与氨水结合,降低看溶液中的银离子浓度,使上述平衡正向移动,使氯化银溶解。

【题目】实验室中有一未知浓度的稀盐酸,某学生为测定盐酸的浓度在实验室中进行如下实验。请你完成下列填空:
步骤一:配制250mL 0.1000mol/L NaOH标准溶液。
步骤二:取20.00mL待测稀盐酸放入锥形瓶中,并滴加2~3滴酚酞溶液作指示剂,用自己配制的标准NaOH溶液进行滴定。重复上述滴定操作2次,记录数据如下。
实验编号 | NaOH溶液的浓度(mol/L) | 滴定完成时,消耗NaOH溶液的体积(mL) | 待测盐酸溶液的体积(mL) |
1 | 0.1000 | 20.02 | 20.00 |
2 | 0.1000 | _______ | 20.00 |
3 | 0.1000 | 19.98 | 20.00 |
(1)步骤一需要称量氢氧化钠固体的质量为__________g,配制标准溶液需要用到玻璃棒、烧杯外,还需要的玻璃仪器有__________________。
(2)步骤二中量取20.00mL的稀盐酸用到的仪器是__________。判断滴定终点的现象是_____
(3)实验2,滴定前液面在“0”刻度处,滴定后液面如图所示,其读数为________mL。根据上述数据,可计算出该盐酸的浓度为__________。

(4)在上述实验中,下列操作(其他操作正确)会造成测定结果(待测液浓度值)偏高的有(_______)
A. 配制标准溶液定容时,仰视刻度线
B. 锥形瓶水洗后直接装待测液
C. 酸式滴定管水洗后未用待测稀盐酸溶液润洗
D. 滴定到达终点时,仰视读出滴定管读数;
E. 碱式滴定管尖嘴部分有气泡,滴定后消失