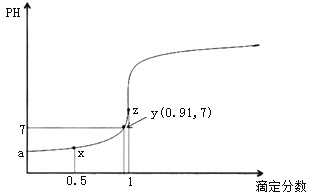
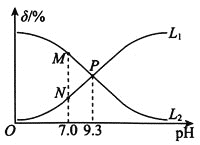
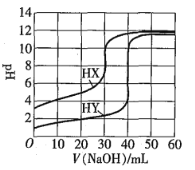
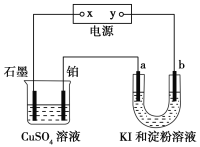
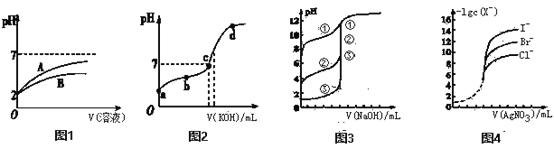
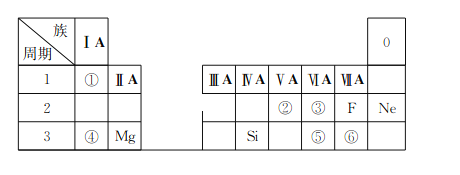
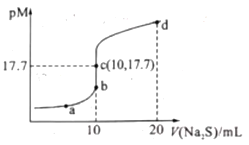
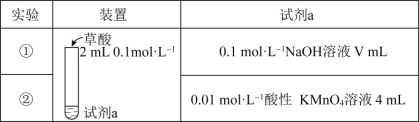0 201617 201625 201631 201635 201641 201643 201647 201653 201655 201661 201667 201671 201673 201677 201683 201685 201691 201695 201697 201701 201703 201707 201709 201711 201712 201713 201715 201716 201717 201719 201721 201725 201727 201731 201733 201737 201743 201745 201751 201755 201757 201761 201767 201773 201775 201781 201785 201787 201793 201797 201803 201811 203614