题目内容
【题目】下表是现行中学化学教科书中元素周期表的一部分,除标出的元素外,表中的每个编号表示一种元素,请根据要求回答问题:
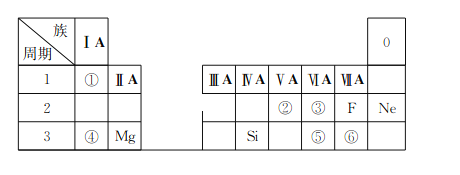
(1)①表示的元素是__________(填元素符号);
(2)②、③两种元素相比较,原子半径较小的是__________(填元素符号);
(3)写出①与⑥两种元素所形成化合物的化学式__________;
(4)③和⑤两种元素的非金属性强弱顺序是③______(填“<”或“>”)⑤;
(5)④和⑥形成化合物的电子式为________。
【答案】H O HCl > ![]()
【解析】
根据元素在周期表中的位置分析元素的种类;根据元素周期律比较原子的半径,元素的非金属性强弱;根据化合物的类型分析书写电子式。
(1)①在元素周期表中处于第1周期第IA族,原子序数为1,则表示的元素是H,故答案为:H;
(2)根据②、③两种元素在元素周期表中的位置可知,分别为N、O元素,同周期主族元素,核电荷越大,原子半径越小,则原子半径较小的是O,故答案为:O;
(3)①为H,⑥为Cl,则两种元素所形成化合物的化学式为HCl,故答案为:HCl;
(4)③为O,⑤为S,两种元素同主族,同主族元素随核电荷增大,非金属性减弱,则非金属性强弱顺序是③>⑤,故答案为:>;
(5)④为Na,⑥为Cl,形成的化合物NaCl为离子化合物,其电子式为![]() ,故答案为:
,故答案为:![]() 。
。

练习册系列答案
 品学双优卷系列答案
品学双优卷系列答案 小学期末冲刺100分系列答案
小学期末冲刺100分系列答案 期末复习检测系列答案
期末复习检测系列答案 超能学典单元期中期末专题冲刺100分系列答案
超能学典单元期中期末专题冲刺100分系列答案 黄冈360度定制密卷系列答案
黄冈360度定制密卷系列答案
相关题目