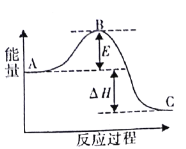
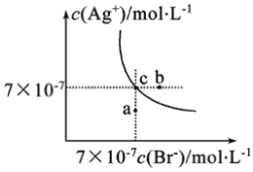
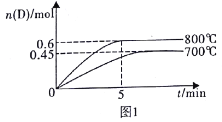
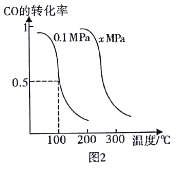
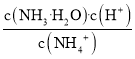【题目】如表实验中,对应的现象和结论都正确,且两者具有因果关系的是( )
选项 | 实验 | 现象 | 结论 |
A | 将少量碳酸钙粉末加入到饱和NH4Cl溶液中 | 产生气体,粉末溶解 | NH4Cl水解使溶液呈酸性 |
B | 将BaSO4固体粉末加入饱和Na2CO3溶液中,搅拌,过滤,洗涤,在滤渣中加入稀盐酸 | 产生气体,滤渣部分溶解 | Ksp(BaCO3)<Ksp(BaSO4) |
C | 将黑色氧化铜粉末进行高温加热 | 黑色变成红色 | CuO分解生成铜单质 |
D | 将某溶液滴加过量的稀盐酸 | 有刺激性气味气体产生,溶液中出现沉淀 | 溶液中一定存在S2-和SO32- |
A.AB.BC.CD.D
【题目】盐在化学工业中有重要的应用,请回答下列问题。
(1)用离子方程式表示FeCl3可作净水剂的原因:______________________________。
(2)常温下,在pH=3的硫酸与pH =11的Na2S溶液中,水电离出来的c(OH-)之比为_______
(3)物质的量浓度相等的下列溶液①NH4Cl②NH4 HSO4③(NH4 ) 2SO4④CH3 COONH4⑤NH3 H2O,溶液中的C(NH4 +)由大到小的顺序是__________________(用序号表示)。
(4)25℃,两种酸的电离平衡常数如下表:
Ka1 | Ka2 | |
H2SO3 | 1.3x10-2 | 6.3x10-8 |
H2CO3 | 4.2x10-7 | 5.6x10-11 |
①0.10 mol L-1NaHSO3溶液中离子浓度由大到小的顺序为__________________
②向NaHCO3溶液中通入少量二氧化硫时反应的离子方程式为__________________________
(5)已知 25 ℃ 时 Ksp[Mg(OH)2] =1.8×10-11, Ksp[Cu(OH)2] =2.2 ×10-20.25 ℃时,向浓度均为0.1 mol L-1的MgCl2和CuCl2混合溶液中逐滴加入氨水,先生成________(填化学式)沉淀;当体系中两种沉淀共存时,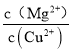 =_______。
=_______。
【题目】某学生用0.1500moVL标准盐酸测定某未知浓度的NaOH溶液,其操作可分解为如下几步:
A.用蒸馏水洗净滴定管
B.用待测定的溶液润洗碱式滴定管
C.用碱式滴定管取NaOH溶液25.00mL,注入锥形瓶中,加入酚酞
D.另取锥形瓶,再重复操作2~3次
E.检查滴定管是否湍水
F.取下酸式滴定管用标准盐酸润洗后,将标准液注入酸式滴定管“0"刻度以上2~3cm处,再把酸式滴定管固定好,调节液面至0"刻度或“0"刻度以下
G.把锥形瓶放在滴定管下面,瓶下垫一张白纸边滴边摇动锥形瓶直至滴定终点,记下滴定管液面所在刻度
完成以下填空:
(1)滴定时正确操作的顺序是(用字母填写)____________________
(2)本实验中对滴定管的操作如下图所示,正确的是______________(填字母)。

(3)判断到达滴定终点的现象是________________________________________
滴定结果如下表所示:
滴定次数 | 待测液体积/mL | 标准溶液的体积/mL | |
滴定前刻度 | 滴定后刻度 | ||
1 | 25.00 | 1.02 | 21.03 |
2 | 25.00 | 0.60 | 20.60 |
3 | 25.00 | 0.20 | 20.19 |
计算该NaOH溶液的物质的量浓度为_____________mol/L
(4)下列操作会导致测定结果偏高的是________
A.酸式滴定管在装液前未用标准盐酸润洗
B.滴定过程中,锥形瓶摇晃的太剧烈,锥形瓶内有液体溅出
C.酸式滴定管尖嘴部分在滴定前没有气泡,滴定终点时发现气泡
D.达到滴定终点时,仰视读数