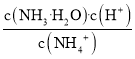题目内容
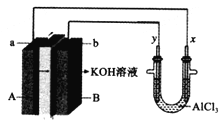
【题目】常温下,在0.2mol/LAlCl3溶液中,逐滴加入1.0mol/LNaOH溶液,实验测得溶液pH随NaOH溶液体积变化曲线如图,下列有关说法正确的( )

A.a点时,溶液呈酸性的原因是Al3+水解,离子方程式为:Al3++3OH-=Al(OH)3
B.b点水的电离程度小于a点
C.通过曲线变化,可估计Al(OH)3的溶度积约为1×10-20
D.d点时,溶液中已无沉淀剩余
【答案】D
【解析】
A.硫酸铝为强酸弱碱盐,水解显酸性,水解离子反应为![]() ,故A错误;
,故A错误;
B.![]() 点溶液pH增大,水解平衡正向移动,铝离子浓度减小,盐类水解程度越大,水的电离程度越大,b点水的电离程度大于a点,故B错误;
点溶液pH增大,水解平衡正向移动,铝离子浓度减小,盐类水解程度越大,水的电离程度越大,b点水的电离程度大于a点,故B错误;
C.![]() 段,加入氢氧根主要用于生成氢氧化铝沉淀,c点时,
段,加入氢氧根主要用于生成氢氧化铝沉淀,c点时,![]() 沉淀开始溶解,铝离子完全沉淀的浓度约为
沉淀开始溶解,铝离子完全沉淀的浓度约为![]() ,溶度积常数
,溶度积常数![]() ,故C错误;
,故C错误;
D.c点后pH发生突变,NaOH过量,![]() 沉淀开始溶解,生成
沉淀开始溶解,生成![]() ,碱性较强,而d点
,碱性较强,而d点![]() ,NaOH远远过量,溶液中已无沉淀剩余,故D正确;
,NaOH远远过量,溶液中已无沉淀剩余,故D正确;
答案选D。

练习册系列答案
相关题目