题目内容
【题目】合成氨反应N2 ( g ) +3H2 ( g ) = 2NH3 ( g ) ,反应过程的能量变化如图所示。已知N2 ( g ) 与 H2( g )反应生成 17 gNH3(g),放出46. 1kJ的热量。请回答下列问题:
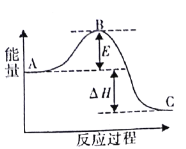
(1)该反应通常用铁作催化剂,加催化剂会使图中E_______________(填“变大”或“变小”) ,E 的大小对该反应的反应热有无影响?___________,理由是__________。
(2)图中△H=________kJ·mol -1。
(3)起始充入2mol·L-1N2和5.5mol·L-1H2,经过50min,NH3的浓度为1mol·L-1,则v(N2)=______mol·L-1·min-1,c(H2)=_____mol·L-1
(4)已知NH3(g)=NH3(l) △H=-QkJ·mol-1,则N2 ( g ) +3H2 ( g ) = 2NH3 ( l )的△H=_______kJ·mol-1
【答案】变小 无 ΔH取决于反应物的总能量和生成物的总能量差 -92.2 0.01 4 -(92.2+2Q)
【解析】
(1)依据催化剂降低反应的活化能加快反应速率分析;反应热取决于反应物和生成物的能量变化,活化能和反应热无关;
(2)结合已知N2(g)与H2(g)反应生成17gNH3(g),放出46.1kJ的热量,分析图象是合成氨反应N2(g)+3H2(g)=2NH3(g),计算得到;
(3)依据化学平衡三段式列式计算;
(4)结合(2)计算的焓变写出反应的热化学方程式,依据盖斯定律计算所需让化学方程式。
(1)催化剂降低反应的活化能加快反应速率,但不改变平衡,反应热不变,E的大小对该反应的反应热无影响,反应热取决于反应物的总能量和生成物的总能量差,故答案为:变小;无;△H取决于反应物的总能量和生成物的总能量差;
(2)已知N2(g)与H2(g)反应生成17gNH3(g),放出46.1kJ的热量,图象是表示的是反应N2(g)+3H2(g)=2NH3(g)能量变化,所以生成34g氨气放热92.2kJ,热化学方程式为:N2(g)+3H2(g)=2NH3(g),△H=-92.2kJ/mol,故答案为:-92.2;
(3)起始充入2molL-1N2和5.5molL-1H2,经过50min,NH3的浓度为1molL-1,则依据所给数据建立如下三段式:
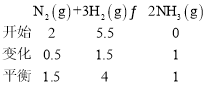
由三段式可得v(N2)=![]() =0.01mol/(Lmin),c(H2)=4mol/L,故答案为:0.01;4;
=0.01mol/(Lmin),c(H2)=4mol/L,故答案为:0.01;4;
(4)由热化学方程式①N2(g)+3H2(g)=2NH3(g)△H=-92.2kJ/mol,②NH3(g)═NH3(l)△H=-QkJmol-1,依据盖斯定律①+②×2得到N2(g)+3H2(g)═2NH3(l)△H=-(92.2+2Q)kJmol-1,故答案为:-(92.2+2Q)。

 习题精选系列答案
习题精选系列答案