题目内容
【题目】![]() 时,下列有关电解质溶液说法正确的是
时,下列有关电解质溶液说法正确的是![]()
![]()
A.稀醋酸中加入冰醋酸,醋酸电离平衡右移,电离度增大
B.向NaF溶液中滴加硫酸至中性时,![]()
C.向氨水中加入![]() 固体,溶液中
固体,溶液中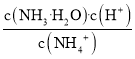 增大
增大
D.AgCl在水和NaCl溶液中的溶度积分别为![]() 、
、![]() ,则
,则![]()
【答案】B
【解析】
A.稀醋酸中加入冰醋酸,醋酸电离平衡右移,但电离度减小,故A错误;
B.向NaF溶液中滴加硫酸至中性时,溶液中物料守恒为:c(Na+)=c(HF)+c(F-),电荷守恒为c(Na+)+c(H+)=c(OH-)+c(F-)+2c(SO42-),消去钠离子的浓度可得:c(HF)+c(H+)=c(OH-)+2c(SO42-),溶液显中性,则c(H+)=c(OH-),所以c(HF)=2c(SO42-),则c(SO42-)<c(HF),故B正确;
C.铵根离子的水解常数Kh=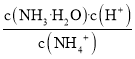 ,溶液的温度不变,水解常数不变,故C错误;
,溶液的温度不变,水解常数不变,故C错误;
D.溶度积只与温度有关,与溶液的浓度无关,所以AgCl在水和NaCl溶液中的溶度积分别为K1、K2,则K1=K2,故D错误;
故答案为B。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】下列实验操作、现象和结论均正确的是( )
选项 | 实验操作 | 现象 | 结论 |
A | 取1mL20%蔗糖溶液,加入适量稀硫酸,水浴加热后取少量溶液,加入几滴新制的Cu(OH)2悬浊液,加热没有砖红色沉淀生成 | 溶液中未出现砖红沉淀 | 蔗糖未水解 |
B | 将C和SiO2的固体混合物加热加热 | 2C+SiO2 | 非金属性:C>Si |
C | 向盛有2mL0.1molL-1的NaCl溶液的试管中逐滴加入几滴0.1molL-1AgNO3溶液,充分反应后,再逐滴加入AgNO3溶液,充分反应后,再逐滴加入0.1molL-1的KI溶液 | 白色沉淀变为黄色沉淀 | Ksp(AgCl)>Ksp(Agl), |
D | 向待测液中加入适量的稀NaOH溶液,将湿润的蓝色石蕊试纸放在试管口 | 湿润的蓝色石蕊试纸未变红 | 待测液中不存在NH4+ |
A.AB.BC.CD.D