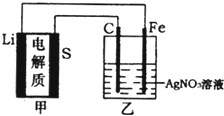
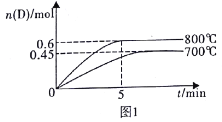
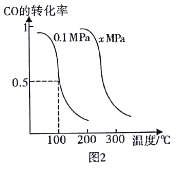
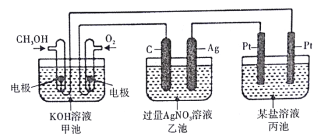
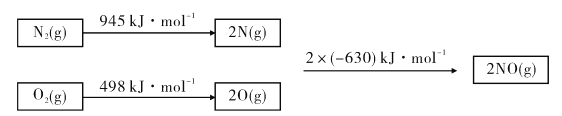
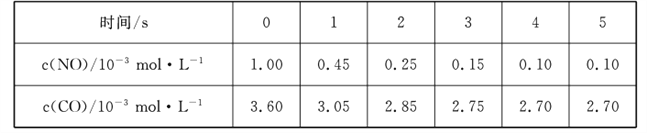
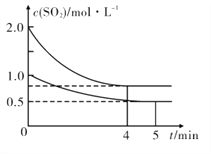
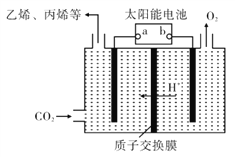
��Ŀ����
����Ŀ�����ڻ�ѧ��ҵ������Ҫ��Ӧ�ã���ش��������⡣
(1)�����ӷ���ʽ��ʾFeCl3������ˮ����ԭ��:______________________________��
(2)�����£���pH=3��������pH =11��Na2S��Һ�У�ˮ���������c(OH-)֮��Ϊ_______
(3)���ʵ���Ũ����ȵ�������Һ��NH4Cl��NH4 HSO4�ۣ�NH4 ) 2SO4��CH3 COONH4��NH3 H2O����Һ�е�C(NH4 +)�ɴ�С��˳����__________________(����ű�ʾ����
(4)25����������ĵ���ƽ�ⳣ�����±���
Ka1 | Ka2 | |
H2SO3 | 1.3x10-2 | 6.3x10-8 |
H2CO3 | 4.2x10-7 | 5.6x10-11 |
��0.10 mol L-1NaHSO3��Һ������Ũ���ɴ�С��˳��Ϊ__________________
����NaHCO3��Һ��ͨ��������������ʱ��Ӧ�����ӷ���ʽΪ__________________________
(5)��֪ 25 �� ʱ Ksp[Mg(OH)2] =1.8��10-11, Ksp[Cu(OH)2] =2.2 ��10-20.25 ��ʱ����Ũ�Ⱦ�Ϊ0.1 mol L-1��MgCl2��CuCl2�����Һ����μ��백ˮ��������________(�ѧʽ������;����ϵ�����ֳ�������ʱ��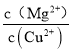 =_______��
=_______��
���𰸡�Fe3++3H2O![]() Fe(OH)3(����)+3H+ 1��108 �ۣ��ڣ��٣��ܣ��� c(Na+)��c(HSO3��)��c(H+)��c(SO32��)��c(OH��) SO2+HCO3��===HSO3��+CO2 Cu(OH)2 8.2��108
Fe(OH)3(����)+3H+ 1��108 �ۣ��ڣ��٣��ܣ��� c(Na+)��c(HSO3��)��c(H+)��c(SO32��)��c(OH��) SO2+HCO3��===HSO3��+CO2 Cu(OH)2 8.2��108
��������
(1)Fe3+����ˮ�����ɾ��н�ǿ�����Ե�Fe(OH)3���壻
(2)�����е�������ȫ����ˮ���룬Na2S��Һ��ˮ�������������ȫ����ˮ���룻
(3)��Ԫ�����笠�����Ũ�����������һԪ�����ˮ�������Ƶģ���������һԪ����Ӳ���Ӱ��ģ�Ȼ����һԪ�����ˮ���ܴٽ��ģ����һԪ���ˮ���ɴ˷������
(4)���ж�NaHSO3�ĵ���̶ȴ���ˮ��̶ȴ����ж���Һ������Ũ�ȴ�С��ϵ��
(5)�ṹ������ͬ�ij����ܶȻ�ԽС�ܽ��ԽС�� Ksp[Mg(OH)2] =c(Mg2+)c2(OH-)��Ksp[Cu(OH)2] = c(Cu2+)c2(OH-)���ݴ˼��㣻
(1)Fe3+����ˮ�����ɾ��н�ǿ�����Ե�Fe(OH)3���壬��Ӧ�����ӷ���ʽΪ��Fe3++3H2OFe(OH)3(����)+3H+��
(2)�����£���pH=3��������Һ��ˮ�����������������Ũ��c(OH-)=![]() =10-11��pH=11��Na2S��Һ��ˮ�����������������Ũ��c(OH-)=
=10-11��pH=11��Na2S��Һ��ˮ�����������������Ũ��c(OH-)=![]() =10-3mol/L��ˮ���������c(OH-)֮��=10-11��10-3=1��108���ʴ�Ϊ��1��108��
=10-3mol/L��ˮ���������c(OH-)֮��=10-11��10-3=1��108���ʴ�Ϊ��1��108��
(3)��Ԫ�����笠�����Ũ�����������һԪ�����ˮ�������Ƶģ���������һԪ����Ӳ���Ӱ��ģ�Ȼ����һԪ�����ˮ���ܴٽ��ģ����һԪ���ˮ��������Һ�е�c(NH4+)�ɴ�С��˳���Ǣۣ��ڣ��٣��ܣ��ݣ��ʴ�Ϊ���ۣ��ڣ��٣��ܣ��ݣ�
(4)��0.10molL-1NaHSO3��Һ��HSO3-ˮ��ƽ�ⳣ��=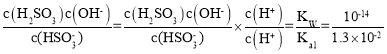 <Ka2��˵��������������ӵ���̶ȴ�����ˮ��̶���Һ�����ԣ����Ե���̶ȴ���ˮ��̶ȣ��������Ũ�ȴ�СΪc(Na+)��c(HSO3-)��c(H+)��c(SO32-)��c(OH-)��
<Ka2��˵��������������ӵ���̶ȴ�����ˮ��̶���Һ�����ԣ����Ե���̶ȴ���ˮ��̶ȣ��������Ũ�ȴ�СΪc(Na+)��c(HSO3-)��c(H+)��c(SO32-)��c(OH-)��
��ͼ�������ݱȽϵõ�������H2SO3��H2CO3��HSO3-��HCO3-����NaHCO3��Һ��ͨ��������������ʱ��Ӧ���ɶ�����̼����Ӧ�����ӷ���ʽΪ��SO2+HCO3-=HSO3-+CO2��
(5)Mg(OH)2��Cu(OH)2�Ľṹ������ͬ��Cu(OH)2�ܶȻ���С���ܽ��ԽС��������ͬ��Ũ�ȵİ�ˮ��Cu(OH)2����������Cu(OH)2����������ʱ����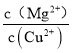 =
=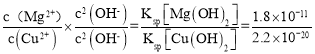 =8.2��108��
=8.2��108��