【题目】已知![]() 时下列物质的溶度积
时下列物质的溶度积![]() 单位略
单位略![]() 。
。
| AgCl |
|
| |
|
|
|
|
|
下列说法正确的是![]()
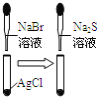
A.等体积、浓度均为![]() 的
的![]() 和
和![]() 溶液混合能产生沉淀
溶液混合能产生沉淀
B.向含有浓度均为![]() 的
的![]() 和
和![]() 的溶液中慢慢滴入
的溶液中慢慢滴入![]() 溶液时,
溶液时,![]() 先沉淀
先沉淀
C.在![]() 悬浊液中加入盐酸时发生反应的离子方程式为
悬浊液中加入盐酸时发生反应的离子方程式为![]()
D.![]() 时,上述四种饱和溶液的物质的量浓度:
时,上述四种饱和溶液的物质的量浓度: ![]()
【题目】25℃时,浓度均为0.1 mol/L的溶液,其pH如下表所示。有关说法正确的是
序号 | ① | ② | ③ | ④ |
溶液 | NaCl | CH3COONH4 | NaF | NaHCO3 |
pH | 7.0 | 7.0 | 8.1 | 8.4 |
A.酸性强弱:H2CO3>HF
B.①和②中溶质均未水解
C.离子的总浓度:①>③
D.④中:c(HCO3-) + 2c(CO32-) + c(H2CO3)![]() 0.1 mol/L
0.1 mol/L
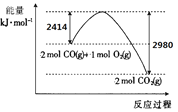
【题目】根据下列实验现象,所得结论正确的是![]()
实验 | 实验现象 | 结论 |
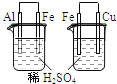
A |
左烧杯中铁表面有气泡,右边烧杯中铜表面有气泡 | 活动性: |
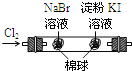
B |
左边棉花变为橙色,右边棉花变为蓝色 | 氧化性: |
C |
白色固体先变为淡黄色,后变为黑色 | 溶解性: |
D |
锥形瓶中有气体产生,烧杯中液体变浑浊 | 非金属性: |
A.AB.BC.CD.D
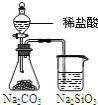
【题目】下表中的实验操作能达到实验目的或能得出相应结论的是![]()
选项 | 实验操作 | 实验目的或结论 |
A | 向一定浓度的 |
|
B | 取少量 | 检验 |
C | 向某溶液中滴加 | 说明原溶液中一定含有 |
D | 将混有 | 除去 |
A.A
【题目】几种主族元素(过渡元素略去)在周期表中的位置如下:
A | |||||||
M | B | D | |||||
E | G | R | J | ||||
T | |||||||
(1)E、G、T的原子半径由大到小的顺序是_____(填元素符号)。
(2)硒元素(34Se)与D同主族,其非金属性比D______(填“强”或“弱”)。
(3)E、G元素最高价氧化物对应水化物之间能反应,离子方程式为:_______。
(4)E、D两元素能形成原子个数比1:1 型化合物的电子式为________。
(5)A与M形成的分子可能是________(填字母序号)。