ƒøƒ⁄»ð
°æƒø°øªÿ ’¿˚”√¡Ú∫Õµ™µƒ—ıªØŒÔ «±£ª§ª∑æ≥µƒ÷ÿ“™æŸ¥Î°£
I£Æ£®1£©π§“µ…˙≤˙ø…¿˚”√CO¥”»º√∫—Ã∆¯÷–Õ—¡Ú°£
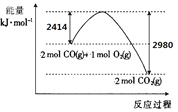
“—÷™S(s)µƒ»º…’»»(°˜H)Œ™-mkJ/mol°£CO”ÎO2∑¥”¶µƒƒÐ¡ø±‰ªØ»ÁÕºÀ˘ 棨‘ÚCO¥”»º√∫—Ã∆¯÷–Õ—¡Úµƒ»»ªØ—ß∑Ω≥Ã ΩŒ™______ (°˜H”√∫¨mµƒ¥˙ ˝ Ω±Ì æ) °£
£®2£©‘⁄ƒ£ƒ‚ªÿ ’¡Úµƒ µ—È÷–£¨œÚƒ≥∫„»ð√б’»ð∆˜÷–Õ®»Î2.8molCO∫Õ1molSO2∆¯Ã£¨∑¥”¶‘⁄≤ªÕ¨Ãıº˛œ¬Ω¯––£¨∑¥”¶ÃÂœµ◊Зπ«øÀÊ ±º‰µƒ±‰ªØ»ÁÕºÀ˘ æ°£
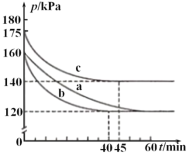
¢Ÿ”Î µ—Èaœý±»£¨ µ—Èc∏ƒ±‰µƒ µ—ÈÃıº˛ø…ƒÐ «_________°£
¢⁄«Î¿˚”√ê˝∑÷ ˝º∆À„∏√Ãıº˛œ¬ µ—Èbµƒ∆Ω∫‚≥£ ˝K=________°££®¡–≥ˆº∆À„ Ωº¥ø…£©£®◊¢£∫ƒ≥ŒÔ÷ µƒÃª˝∑÷ ˝=∏√ŒÔ÷ µƒŒÔ÷ µƒ¡ø/∆¯Ãµƒ◊ÐŒÔ÷ µƒ¡ø£©
£®3£©À´ºÓ∑®≥˝»•SO2µƒ‘≠¿ÌŒ™£∫NaOH»Ð“∫![]() Na2SO3»Ð“∫°£∏√∑Ω∑®ƒÐ∏þ–ß≥˝»•SO2≤¢ªÒµ√ Ø∏ý°£
Na2SO3»Ð“∫°£∏√∑Ω∑®ƒÐ∏þ–ß≥˝»•SO2≤¢ªÒµ√ Ø∏ý°£
¢Ÿ∏√π˝≥Ã÷–NaOH»Ð“∫µƒ◊˜”√ «_______°£
¢⁄25°Ê ±,Ω´“ª∂®¡øµƒSO2Õ®»ÎµΩ100mL0.1mol/LµƒNaOH»Ð“∫÷–£¨¡Ω’þÕÍ»´∑¥”¶µ√µΩ∫¨Na2SO3°¢NaHSO3µƒªÏ∫œ»Ð“∫£¨»Ð“∫«°∫√≥ ÷––‘£¨‘ڻГ∫÷–H2SO3µƒŒÔ÷ µƒ¡ø≈®∂» «____£®ºŸ…Ë∑¥”¶«∞∫ۻГ∫ê˝≤ª±‰£ª25°Ê ±£¨H2SO3µƒµÁ¿Î≥£ ˝ K1=1.0°¡10-2 K2=5.0°¡10-8)°£
II£Æ”√NH3œ˚≥˝NOŒ€»æµƒ∑¥”¶‘≠¿ÌŒ™£∫4NH3(g)+6NO(g)![]() 5N2(g)+6H2O(l) °˜H= -1807.98kJ/mol °£≤ªÕ¨Œ¬∂»Ãıº˛œ¬£¨NH3”ÎNOµƒŒÔ÷ µƒ¡ø÷Ʊ»∑÷±Œ™4:1°¢3:1°¢1:3£¨µ√µΩNOÕ—≥˝¬ «˙œþ»ÁÕºÀ˘ æ°£
5N2(g)+6H2O(l) °˜H= -1807.98kJ/mol °£≤ªÕ¨Œ¬∂»Ãıº˛œ¬£¨NH3”ÎNOµƒŒÔ÷ µƒ¡ø÷Ʊ»∑÷±Œ™4:1°¢3:1°¢1:3£¨µ√µΩNOÕ—≥˝¬ «˙œþ»ÁÕºÀ˘ æ°£
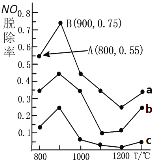
£®1£©«˙œþa÷–NH3µƒ∆ º≈®∂»Œ™4°¡10-5mol/L,¥”Aµ„µΩBµ„æ≠π˝1√Σ¨∏√ ±º‰∂Œƒ⁄NOµƒÕ—≥˝ÀŸ¬ Œ™____mg/(L°§s)°£
£®2£©≤ª¬€“‘∫Œ÷÷±»¿˝ªÏ∫œ£¨Œ¬∂»≥¨π˝900°Ê£¨NOÕ—≥˝¬ ÷Ë»ªœ¬Ωµ£¨≥˝¡À‘⁄∏þŒ¬Ãıº˛œ¬µ™∆¯”Ηı∆¯∑¢…˙∑¥”¶…˙≥…NO£¨ø…ƒÐµƒ‘≠“Úªπ”–£®“ªÃıº¥ø…£©____°£
°æ¥∞∏°ø2CO£®g£©+SO2£®g£©=S£®l£©+2CO2£®g£©°˜H=(m-566)kJ°§mol£≠1 …˝Œ¬ 1.9°¡1.9°¡2.85/£®0.9°¡0.9°¡0.05£© ¥þªØº¡ 5°¡10-7mol/L 6°¡10-2£®ªÚ0.06£© ∏√∑¥”¶µƒ’˝∑¥”¶∑≈»»∑¥”¶£¨…˝∏þŒ¬∂»£¨∆Ω∫‚œÚƒÊ∑¥”¶∑ΩœÚ“∆∂Ø
°æΩ‚Œˆ°ø
I£Æ£®1£©∏˘æð‘≠◊” ÿ∫„£¨CO”ÎSO2∑¥”¶…˙≥…S£®1£©∫Õ“ª÷÷ŒÞ∂浃∆¯Ã «CO2£¨ªØ—ß∑Ω≥Ã ΩŒ™2CO£®g£©+SO2£®g£©=S£®l£©+2CO2£®g£©£¨¿˚”√Â∏¯¡Ω∏ˆ»»ªØ—ß∑Ω≥à ΩΩ·∫œ∏«Àπ∂®¬…Ω¯––«ÛÀ„°£
£®2£©¢Ÿa°¢cø™ ºæ˘Õ®»Î2.8mol CO∫Õ1mol SO2£¨»ð∆˜µƒ»ðª˝œýÕ¨£¨∂¯∆ º ±cµƒ—π«ø¥Û”⁄a£¨ŒÔ÷ µƒ¡ø”Îê˝“ª∂®£¨—π«ø”ÎŒ¬∂»≥ ’˝±»πÿœµ£ª
¢⁄∆¯Ã—π«ø÷Ʊ»µ»”⁄∆¯ÃÂŒÔ÷ µƒ¡ø÷Ʊ»£¨Ω·∫œ»˝–– Ωº∆À„¡– Ωµ√µΩ≤Œº”∑¥”¶µƒ∂˛—ıªØ¡ÚŒÔ÷ µƒ¡ø£ª‘Ÿº∆À„∏˜ŒÔ÷ µƒÃª˝∑÷ ˝£¨–¥≥ˆ∆Ω∫‚≥£ ˝°£
£®3£©¢Ÿ”√NaOHŒ¸ ’SO2£¨≤¢”√CaO πNaOH‘Ÿ…˙°£2NaOH+SO2=Na2SO3£¨NaOH‘Ÿ…˙CaO+H2O+Na2SO3®TCaSO3+2NaOH£¨¥”∑¥”¶ø…“‘ø¥≥ˆNaOH◊˜¥þªØº¡°£
¢⁄∏˘æðµÁ∫… ÿ∫„∫ÕµÁ¿Î∑Ω≥Ã Ω°¢µÁ¿Î∆Ω∫‚≥£ ˝Ω‚¥£ª
II£Æ£®1£©¡Ω÷÷∑¥”¶ŒÔ¥Ê‘⁄µƒ∑¥”¶£¨‘ˆ¥Û“ª÷÷∑¥”¶ŒÔµƒ¡øø…÷∏þ¡Ì“ª÷÷∑¥”¶ŒÔµƒ◊™ªØ¬ £¨∏˘æðÕºœÛ£¨«˙œþaµƒNOÕ—≥˝¬ ◊Ó∏þ£¨º¥NOµƒ◊™ªØ¬ ◊Ó∏þ£¨À˘“‘NOµƒ‘⁄◊Ð∑¥”¶ŒÔ÷–µƒ±»¿˝◊ÓµÕ£¨NH3”ÎNOµƒŒÔ÷ µƒ¡ø÷Ʊ»∑÷±Œ™4:1£¨∏˘æðNOµƒÕ—≥˝¡ø±‰ªØ÷µ∫ÕÕ—≥˝ ±º‰º∆À„NOµƒÕ—≥ˆÀŸ¬ £ª
£®2£©∂‘∑≈»»∑¥”¶£¨…˝∏þŒ¬∂»£¨∆Ω∫‚œÚƒÊ∑¥”¶∑ΩœÚ“∆∂Ø°£
I£Æ£®1£©∏˘æð‘≠◊” ÿ∫„£¨…˙≥…µƒŒÞ∂æ∆¯Ã «∂˛—ıªØú£¨∑¢…˙µƒ∑¥”¶Œ™2CO£®g£©+SO2£®g£©=S£®l£©+2CO2£®g£©°£Ω´Ã‚∏¯¡Ω∏ˆ»»ªØ—ß∑Ω≥Ã Ω¢Ÿ2CO£®g£©+O2£®g£©=2CO2£®g£©°˜H1=-566kJ°§mol£≠1∫Õ¢⁄S£®l£©+O2£®g£©=SO2£®g£©°˜H2=-mkJ°§mol£≠1£¨∏˘æð∏«Àπ∂®¬…¢Ÿ-¢⁄ø…µ√À˘«Û∑¥”¶µƒ»»ªØ—ß∑Ω≥Ã Ω£¨º¥2CO£®g£©+SO2£®g£©=S£®l£©+2CO2£®g£©°˜H=-566kJ°§mol£≠1-£®-mkJ°§mol£≠1£©=(m-566)kJ°§mol£≠1°£
£®2£©¢Ÿa°¢cø™ ºæ˘Õ®»Î2.8mol CO∫Õ1mol SO2£¨»ð∆˜µƒ»ðª˝œýÕ¨£¨∂¯∆ º ±cµƒ—π«ø¥Û”⁄a£¨ŒÔ÷ µƒ¡ø”Îê˝“ª∂®£¨—π«ø”ÎŒ¬∂»≥ ’˝±»πÿœµ£¨π c◊È∏ƒ±‰µƒ µ—ÈÃıº˛ø…ƒÐ «£∫…˝∏þŒ¬∂»£ª
¢⁄ 2CO£®g£©+SO2£®g£©![]() 2CO2£®g£©+S£®l£©£¨…Ëœ˚∫ƒ∂˛—ıªØ¡ÚŒÔ÷ µƒ¡øx£¨
2CO2£®g£©+S£®l£©£¨…Ëœ˚∫ƒ∂˛—ıªØ¡ÚŒÔ÷ µƒ¡øx£¨
∆ º¡ø£®mol£© 2.8 1 0
±‰ªØ¡ø£®mol£© 2x x 2x
∆Ω∫‚¡ø£®mol£©2.8-2x 1-x 2x
£®2.8+1£©/(2.8+1-x)=160/120
x=0.95mol£¨
CO°¢SO2 °¢CO2 µƒÃª˝∑÷ ˝∑÷±Œ™0.9/2.85°¢0.05/2.85°¢1.9/2.85
K=1.9°¡1.9°¡2.85/£®0.9°¡0.9°¡0.05£©°£
£®3£©¢Ÿ”√NaOHŒ¸ ’SO2£¨≤¢”√CaO πNaOH‘Ÿ…˙°£2NaOH+SO2=Na2SO3£¨NaOH‘Ÿ…˙CaO+H2O+Na2SO3®TCaSO3+2NaOH£¨¥”∑¥”¶ø…“‘ø¥≥ˆNaOH◊˜¥þªØº¡°£
¢⁄∏˘æðµÁ∫… ÿ∫„£∫c£®Na£´£©+c£®H£´£©=c£®OH£≠£©+2c£®SO32£≠£©+c£®HSO3£≠£©£¨»Ð“∫≥ ÷––‘£∫c£®OH£≠£©=c£®H£´£©£¨µ√c£®Na£´£©=2c£®SO32£≠£©+c£®HSO3£≠£©£¨¡Óc£®HSO3£≠£©=x,c£®SO32£≠£©=(0.1-x)/2,∏˘æðHSO3£≠![]() SO32£≠+H£´£¨k2=5.0°¡10-8=c£®SO32£≠£©c£®H£´£©/c£®HSO3£≠£©£¨5.0°¡108=10-7°¡(0.1-x)/2x,µ√x=0.05mol°§L£≠1£¨c£®SO32£≠£©=0.025mol°§L£≠1£¨¥˙»Îk1£¨H2SO3
SO32£≠+H£´£¨k2=5.0°¡10-8=c£®SO32£≠£©c£®H£´£©/c£®HSO3£≠£©£¨5.0°¡108=10-7°¡(0.1-x)/2x,µ√x=0.05mol°§L£≠1£¨c£®SO32£≠£©=0.025mol°§L£≠1£¨¥˙»Îk1£¨H2SO3![]() HSO3£≠£´H£´£¨k1=1°¡10-2=c£®HSO3£≠£©c£®H£´£©/c(H2SO3)£¨c(H2SO3)=c£®HSO3£≠£©c£®H£´£©/10-2=0.05°¡10-7/10-2=5°¡10-7mol°§L£≠1.
HSO3£≠£´H£´£¨k1=1°¡10-2=c£®HSO3£≠£©c£®H£´£©/c(H2SO3)£¨c(H2SO3)=c£®HSO3£≠£©c£®H£´£©/10-2=0.05°¡10-7/10-2=5°¡10-7mol°§L£≠1.
II£Æ£®1£©«˙œþa÷–NH3µƒ∆ º≈®∂»Œ™4°¡10-5mol°§L£≠1£¨º¥NOµƒ∆ º≈®∂»Œ™£∫1°¡10-5mol°§L£≠1£¨¥”Aµ„µΩBµ„æ≠π˝1√Σ¨∏˘æðÕºœÛ£¨NOµƒÕ—≥˝¬ ¥”55%…œ…˝µΩ75%£¨‘Ú∏√∂Œ ±º‰ƒ⁄NOµƒÕ—≥˝¡øŒ™°˜c=1°¡10-5mol/L°¡£®75%-55%£©=2°¡10-6mol/L£¨ ±º‰º‰∏ÙŒ™°˜t=1s£¨À˘“‘∏√∂Œ ±º‰ƒ⁄NOµƒÕ—≥˝ÀŸ¬ Œ™=2°¡10-6mol°§L£≠1/1s=2°¡10-6mol/(L°§s£©£¨NO Ω¡øŒ™30£¨º¥6°¡10-2mg/(L°§s£©£ª
£®2£©≤ª¬€“‘∫Œ÷÷±»¿˝ªÏ∫œ£¨Œ¬∂»≥¨π˝900°Ê£¨NOÕ—≥˝¬ ÷Ë»ªœ¬Ωµ£¨≥˝¡À‘⁄∏þŒ¬Ãıº˛œ¬µ™∆¯”Ηı∆¯∑¢…˙∑¥”¶…˙≥…NO£¨ø…ƒÐµƒ‘≠“Úªπ”–∏√∑¥”¶µƒ’˝∑¥”¶∑≈»»∑¥”¶£¨…˝∏þŒ¬∂»£¨∆Ω∫‚œÚƒÊ∑¥”¶∑ΩœÚ“∆∂Ø°£

 Ω≈∆ΩÃ∏®≈ý”≈”≈—°æÌ∆⁄ƒ©≥Â¥Ã100∑÷œµ¡–¥∞∏
Ω≈∆ΩÃ∏®≈ý”≈”≈—°æÌ∆⁄ƒ©≥Â¥Ã100∑÷œµ¡–¥∞∏°æƒø°øº∏÷÷÷˜◊‘™Àÿ(π˝∂…‘™Àÿ¬‘»•)‘⁄÷Ð∆⁄±Ì÷–µƒŒª÷√»Áœ¬:
A | |||||||
M | B | D | |||||
E | G | R | J | ||||
T | |||||||
(1)E°¢G°¢Tµƒ‘≠◊”∞Îæ∂”…¥ÛµΩ–°µƒÀ≥–Ú «_____(ÃÓ‘™Àÿ∑˚∫≈)°£
(2)Œ¯‘™Àÿ(34Se)”ÎDÕ¨÷˜◊£¨∆‰∑«Ω Ù–‘±»D______(ÃÓ°∞«ø°±ªÚ°∞»ı°±)°£
(3)E°¢G‘™Àÿ◊Ó∏þº€—ıªØŒÔ∂‘”¶Àƪ،Ô÷ƺ‰ƒÐ∑¥”¶£¨¿Î◊”∑Ω≥Ã ΩŒ™:_______°£
(4)E°¢D¡Ω‘™ÀÿƒÐ–Œ≥…‘≠◊”∏ˆ ˝±»1:1 –ÕªØ∫œŒÔµƒµÁ◊” ΩŒ™________°£
(5)A”ÎM–Œ≥…µƒ∑÷◊”ø…ƒÐ «________(ÃÓ◊÷ƒ∏–Ú∫≈)°£