��Ŀ����
����Ŀ����������Ԫ��(����Ԫ����ȥ)�����ڱ��е�λ������:
A | |||||||
M | B | D | |||||
E | G | R | J | ||||
T | |||||||
(1)E��G��T��ԭ�Ӱ뾶�ɴ�С��˳����_____(��Ԫ�ط���)��
(2)��Ԫ��(34Se)��Dͬ���壬��ǽ����Ա�D______(����ǿ����������)��
(3)E��GԪ������������Ӧˮ����֮���ܷ�Ӧ�����ӷ���ʽΪ:_______��
(4)E��D��Ԫ�����γ�ԭ�Ӹ�����1:1 �ͻ�����ĵ���ʽΪ________��
(5)A��M�γɵķ��ӿ�����________(����ĸ���)��

���𰸡�K��Na��Al �� Al(OH)3+OH-=![]() +2H2O
+2H2O ![]() ��
��
��������
����Ԫ����Ԫ�����ڱ��е�λ�ÿ�֪��AΪHԪ�أ�MΪCԪ�أ�BΪNԪ�أ�DΪOԪ�أ�EΪNaԪ�أ�GΪAlԪ�أ�RΪSԪ�أ�JΪClԪ�أ�TΪKԪ�أ��ݴ˽����ɷ������
(1)��������������֪��EΪNaԪ�أ�GΪAlԪ�أ�TΪKԪ�أ�ͬ����Ԫ�ش�������ԭ�Ӱ뾶���μ�С��ͬ����Ԫ�����϶���ԭ�Ӱ뾶���μ�С�����ԭ�Ӱ뾶��K��Na��Al��
(2)��Ԫ��(34Se)��Oͬ���壬λ��O���·���ͬ����Ԫ�����϶��·ǽ��������μ����������Ԫ��(34Se)�ķǽ����Ա�O����
(3)Na��AlԪ�ص�����������Ӧˮ����ֱ�ΪNaOH��Al(OH)3�����߷�Ӧ�����ӷ���ʽΪAl(OH)3+OH-=![]() +2H2O��
+2H2O��
(4)Na��O��Ԫ���γ�ԭ�Ӹ�����Ϊ1��1�͵Ļ�����ΪNa2O2��Na2O2�����ӻ����Na+��![]() �γ����Ӽ���
�γ����Ӽ���![]() ��Oԭ�Ӻ�Oԭ�Ӽ��γɹ��ۼ��������ʽΪ
��Oԭ�Ӻ�Oԭ�Ӽ��γɹ��ۼ��������ʽΪ![]() ��
��
(5)Cԭ���������4�����ӣ�����Hԭ���γ�4�Թ��õ��Ӷԣ���H��C���γɼ��飬��������ģ��Ϊ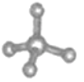 ���ʴ�ѡ�ۡ�
���ʴ�ѡ�ۡ�

 �������Ͽ��㱾ϵ�д�
�������Ͽ��㱾ϵ�д�