题目内容
【题目】已知![]() 时下列物质的溶度积
时下列物质的溶度积![]() 单位略
单位略![]() 。
。
| AgCl |
|
| |
|
|
|
|
|
下列说法正确的是![]()
A.等体积、浓度均为![]() 的
的![]() 和
和![]() 溶液混合能产生沉淀
溶液混合能产生沉淀
B.向含有浓度均为![]() 的
的![]() 和
和![]() 的溶液中慢慢滴入
的溶液中慢慢滴入![]() 溶液时,
溶液时,![]() 先沉淀
先沉淀
C.在![]() 悬浊液中加入盐酸时发生反应的离子方程式为
悬浊液中加入盐酸时发生反应的离子方程式为![]()
D.![]() 时,上述四种饱和溶液的物质的量浓度:
时,上述四种饱和溶液的物质的量浓度: ![]()
【答案】C
【解析】
A.浓度熵QC=c(CH3COO-)×c(Ag+)=0.01×0.01=1×10-4,Ksp=2.3 ×10-3,QC< Ksp ,所以溶液混合不能产生沉淀,故A错误;
B. AgCl饱和所需Ag+浓度=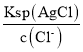 =
=![]() =1.77×10-8,所以Ag+浓度=
=1.77×10-8,所以Ag+浓度= =
=![]() =1.1×10-5,则1.77×10-8<1.1×10-5,所以氯离子先沉淀,故B错误;
=1.1×10-5,则1.77×10-8<1.1×10-5,所以氯离子先沉淀,故B错误;
C.![]() ,向
,向![]() 悬浊液中加入盐酸时
悬浊液中加入盐酸时![]() 转化为AgCl,离子方程式为
转化为AgCl,离子方程式为![]() ,故C正确;
,故C正确;
D.因为CH3COOAg饱和溶液中Ag+的浓度为![]() mol/L=4.8 ×10-2mol/L,因为AgCl 饱和溶液中Ag+的浓度为
mol/L=4.8 ×10-2mol/L,因为AgCl 饱和溶液中Ag+的浓度为![]() mol/L=1.33×10-5 mol/L ,c(AgCl)= 1.33×10-5 mol/L,假设Ag2CrO4饱和溶液中Ag+的浓度为x,则CrO42-的浓度为0.5x,由溶度积常数的表达式可知Ksp(Ag2CrO4) =x2×0.5x=1.12×10-12,即x=
mol/L=1.33×10-5 mol/L ,c(AgCl)= 1.33×10-5 mol/L,假设Ag2CrO4饱和溶液中Ag+的浓度为x,则CrO42-的浓度为0.5x,由溶度积常数的表达式可知Ksp(Ag2CrO4) =x2×0.5x=1.12×10-12,即x=![]() =1.3×10-4mol/L,c( Ag2CrO4) =0.65×10-4mol/L。假设Ag2S饱和溶液中Ag+的浓度为x,则S2-的浓度为0.5x,由溶度积常数的表达式可知Ksp(Ag2S) = x2×0.5x =6.7×10-15 ,即x=2.38×10-5 mol/L,c(Ag2S) =1.19×10-5mol/L ,则顺序为:c(CH3COOAg)>c( Ag2CrO4)>c(AgCl) >c(Ag2S),故D错误;
=1.3×10-4mol/L,c( Ag2CrO4) =0.65×10-4mol/L。假设Ag2S饱和溶液中Ag+的浓度为x,则S2-的浓度为0.5x,由溶度积常数的表达式可知Ksp(Ag2S) = x2×0.5x =6.7×10-15 ,即x=2.38×10-5 mol/L,c(Ag2S) =1.19×10-5mol/L ,则顺序为:c(CH3COOAg)>c( Ag2CrO4)>c(AgCl) >c(Ag2S),故D错误;
故选:C。

