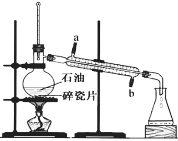
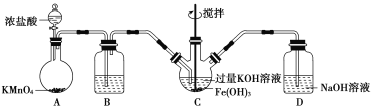
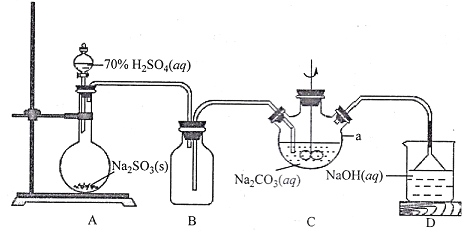
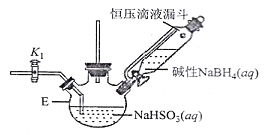
【题目】汽车尾气脱硝脱碳的主要原理为2NO(g)+2CO(g)N2(g)+2CO2(g) ΔH<0。在一定温度下,体积固定为2L的密闭容器中,用传感器测得该反应在不同时间的NO和CO浓度如表所示:
时间/s | c(NO)/(mol·L-1) | c(CO)/(mol·L-1) |
0 | 9.50×10-3 | 9.00×10-3 |
1 | 4.50×10-3 | 4.00×10-3 |
2 | 2.50×10-3 | 2.00×10-3 |
3 | 1.50×10-3 | 1.00×10-3 |
4 | 1.50×10-3 | 1.00×10-3 |
下列说法正确的是
A.前2 s内的平均反应速率v(N2)=3.5×10-3mol·L-1·s-1
B.升高温度时,逆反应速率增大,正反应速率减小
C.容器内气体压强不再发生变化时,反应达到平衡状态
D.容器中气体的浓度c(NO):c(CO):c(N2):c(CO2)=2:2:1:2时,反应达到平衡状态
【题目】已知:KClO3+6HCl(浓)===KCl+3Cl2↑+3H2O.如图所示,将少量试剂分别放入培养皿中的相应位置,实验时将浓盐酸滴在 KClO3 晶体上,并用表面皿盖好。下表中由实验现象得出的结论完全正确的是 ( )
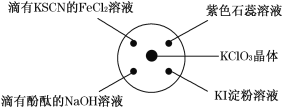
选项 | 实验现象 | 结论 |
A | 滴有 KSCN 的 FeCl2 溶液变红色 | Cl2 具有还原性 |
B | 滴有酚酞的 NaOH 溶液褪色 | Cl2 具有酸性 |
C | 淀粉 KI 溶液中变蓝色 | Cl2 具有氧化性 |
D | 石蕊溶液先变为红色后褪色 | Cl2 具有漂白性 |
A. A B. B C. C D. D