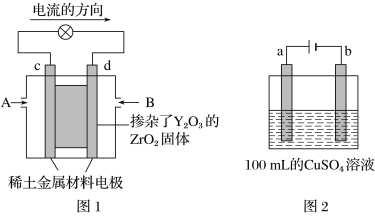
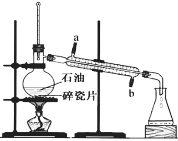
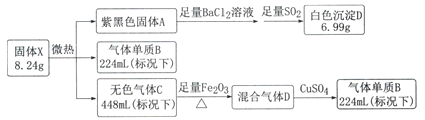
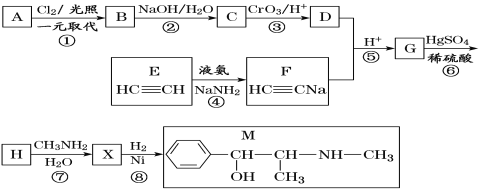
题目内容
【题目】汽车尾气脱硝脱碳的主要原理为2NO(g)+2CO(g)N2(g)+2CO2(g) ΔH<0。在一定温度下,体积固定为2L的密闭容器中,用传感器测得该反应在不同时间的NO和CO浓度如表所示:
时间/s | c(NO)/(mol·L-1) | c(CO)/(mol·L-1) |
0 | 9.50×10-3 | 9.00×10-3 |
1 | 4.50×10-3 | 4.00×10-3 |
2 | 2.50×10-3 | 2.00×10-3 |
3 | 1.50×10-3 | 1.00×10-3 |
4 | 1.50×10-3 | 1.00×10-3 |
下列说法正确的是
A.前2 s内的平均反应速率v(N2)=3.5×10-3mol·L-1·s-1
B.升高温度时,逆反应速率增大,正反应速率减小
C.容器内气体压强不再发生变化时,反应达到平衡状态
D.容器中气体的浓度c(NO):c(CO):c(N2):c(CO2)=2:2:1:2时,反应达到平衡状态
【答案】C
【解析】
A.前2s内△c(CO)=(9.00×10-3-2.00×10-3)mol/L=7.00×10-3mol/L,则△c(N2)=3.50×10-3mol/L,v(N2)=![]() =1.75×10-3molL-1s-1,故A 错误;
=1.75×10-3molL-1s-1,故A 错误;
B.升高温度时,由于增大了活化分子百分数,正逆反应速率都增大,故B错误;
C.该反应为气体体积缩小的反应,反应过程中压强为变量,当容器内气体的压强不再发生变化时,说明正逆反应速率相等,该反应达到平衡状态,故C正确;
D.容器中气体的浓度c(NO):c(CO):c(N2):c(CO2)=2:2:1:2时,不能说明各组分浓度不变,不能说明达到平衡状态,故D 错误;
答案为C。

 时刻准备着暑假作业原子能出版社系列答案
时刻准备着暑假作业原子能出版社系列答案 暑假衔接教材期末暑假预习武汉出版社系列答案
暑假衔接教材期末暑假预习武汉出版社系列答案 假期作业暑假成长乐园新疆青少年出版社系列答案
假期作业暑假成长乐园新疆青少年出版社系列答案【题目】下列实验操作、实验现象和实验结论均正确的是( )
选项 | 实验操作 | 实验现象 | 实验结论 |
A | 将Al2(SO4)3溶液和NaHCO3溶液混合 | 产生白色沉淀,并有大量气体生成 | 生成Al2(CO3)3沉淀和CO2气体 |
B | 在淀粉溶液中加入几滴稀硫酸,水浴5min,加入NaOH溶液调溶液pH至碱性,再加入新制的Cu(OH)2悬浊液,加热 | 有红色沉淀生成 | 淀粉完全水解 |
C | 将少量SO2气体通过足量Na2O2 | 余下气体能使带火星木条复燃 | 有O2生成 |
D | 用pH试纸分别测定等浓度的A、B两溶液(可能为NaHCO3或者Na2CO3)的pH值 | pHA> pHB | A溶液为Na2CO3溶液 |
A. A B. B C. C D. D