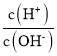题目内容
【题目】保险粉(Na2S2O4)广泛应用于造纸、印染、环保、医药等行业。该物质具有强还原性,在空气中易被氧化,受热易分解,在碱性条件下比较稳定,易溶于水、不溶于乙醇。保险粉可以通过 NaHSO3与NaBH4反应制取。请按要求回答下列问题:
I.NaHSO3溶液的制备
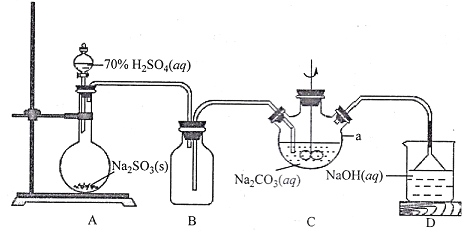
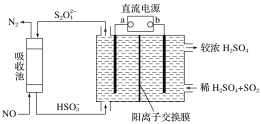
(1)上图仪器a的名称___________;装置C中反应后溶液pH=4.1,则发生反应的化学方程式为___________。
II.保险粉的制备
打开下图(部分装置已省略)中活塞K1通入氮气,一段时间后,关闭K1,打开恒压滴液漏斗活塞向装置E中滴入碱性NaBH4溶液,在30-40℃下充分反应。向反应后的溶液中加入乙醇,经冷却结晶、过滤得到Na2S2O4·2H2O晶体,再用乙醇洗涤、真空烘干脱去晶体结晶水得到保险粉。
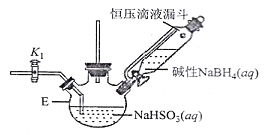
(2)反应产物中有NaBO2,无气体。写出E中发生反应的化学方程式___________。
(3)通入氮气的作用是______________________。
(4)使用乙醇洗涤Na2S2O4·2H2O晶体的优点:______________________。
(5)对装置E的加热方式最好采用______________________。
Ⅲ.保险粉的纯度测定
(6)称取2.0g Na2S2O4样品溶于冷水配成200mL溶液,取出25.00mL该溶液于锥形瓶中,用0.10mol/L碱性K3[Fe(CN)6]标准溶液滴定,原理为:4[Fe(CN)6]3-+2S2O42-+8OH-=4[Fe(CN)6]4-+4SO32-+4H2O,用亚甲基蓝为指示剂,达到滴定终点时消耗标准溶液24.00mL,则样品中Na2S2O4的质量分数为___________(杂质不参与反应)(计算结果精确至0.1%)。
【答案】三颈烧瓶 2SO2+Na2CO3+H2O=2NaHSO3+CO2 NaBH4+8NaHSO3![]() NaBO2+4Na2S2O4+6H2O 将装置E中空气赶出,防止NaHSO3 (或Na2S2O4)被氧化 减少保险粉的溶解损失(并有利于干燥) 水浴加热 83.5%
NaBO2+4Na2S2O4+6H2O 将装置E中空气赶出,防止NaHSO3 (或Na2S2O4)被氧化 减少保险粉的溶解损失(并有利于干燥) 水浴加热 83.5%
【解析】
I.在烧瓶中H2SO4与Na2SO3发生复分解反应制取SO2气体,产生的气体通过安全瓶后进入到三颈烧瓶中,与NaOH、Na2CO3溶液发生反应制取得到NaHSO3;SO2是大气污染物,在排放前要用NaOH溶液进行尾气处理;
II.将上述制得的NaHSO3放入三颈烧瓶E中,与恒压滴液漏斗中加入的NaBH4发生反应产生NaBO2、Na2S2O4及水,为防止空气将NaHSO3 或制取得到Na2S2O4氧化,在反应前先向装置中通入N2或惰性气体;为使反应温度在30-40℃下进行,可利用水浴加热的温度便于控制及受热均匀的特点,进行水浴加热;为减小洗涤Na2S2O4·2H2O晶体时造成的损失,可用无水乙醇进行洗涤;
III. 用亚甲基蓝为指示剂,根据反应4[Fe(CN)6]3-+2S2O42-+8OH-=4[Fe(CN)6]4-+4SO32-+4H2O中K3[Fe(CN)6]与Na2S2O4的物质的量关系,计算出Na2S2O4的质量,再根据物质的含量计算方法得到样品中Na2S2O4的质量分数。
(1)根据上图仪器a的结构可知a仪器的名称是三颈烧瓶;A装置产生的SO2气体在C中与容器中的NaOH、Na2CO3发生反应,反应后溶液pH=4.1<7,溶液显酸性,说明得到的是NaHSO3,则发生反应的化学方程式为2SO2+Na2CO3+H2O=2NaHSO3+CO2;
(2)在装置E中,NaHSO3与由恒压滴液漏斗中加入的NaBH4发生反应产生NaBO2、Na2S2O4及水,根据电子守恒、原子守恒,可得E中发生反应的化学方程式为:NaBH4+8NaHSO3 ![]() NaBO2+4Na2S2O4+6H2O;
NaBO2+4Na2S2O4+6H2O;
(3)在装置内的空气中含有的氧气具有氧化性,容易将反应物NaHSO3氧化,也容易将反应产生的Na2S2O4氧化,所以为防止发生氧化反应,要先通入N2,将装置内的空气排出,因此通入氮气的作用是将装置E中空气赶出,防止NaHSO3 (或Na2S2O4)被氧化;
(4)从溶液中析出的Na2S2O4·2H2O晶体表面有杂质离子,为将杂质洗去,同时降低物质由于洗涤溶解晶体造成的损失,同时便于晶体的干燥,要使用乙醇洗涤Na2S2O4·2H2O;
(5)在装置E中发生反应NaBH4+8NaHSO3 ![]() NaBO2+4Na2S2O4+6H2O,温度在30-40℃下进行,温度低于水的沸点100℃,为便于控制温度及水浴加热具有受热均匀的特点,可采用水浴加热的方式;
NaBO2+4Na2S2O4+6H2O,温度在30-40℃下进行,温度低于水的沸点100℃,为便于控制温度及水浴加热具有受热均匀的特点,可采用水浴加热的方式;
(6)根据4[Fe(CN)6]3-+2S2O42-+8OH-=4[Fe(CN)6]4-+4SO32-+4H2O可知n(Na2S2O4)=![]() n(K3[Fe(CN)6])=
n(K3[Fe(CN)6])=![]() ×0.10mol/L×0.024L×
×0.10mol/L×0.024L×![]() =9.6×10-3mol,m(Na2S2O4)= n(Na2S2O4)×M=9.6×10-3mol×174g/mol=1.6704g,则样品中Na2S2O4的质量分数为(1.6704g÷2.0g)×100%=83.5%。
=9.6×10-3mol,m(Na2S2O4)= n(Na2S2O4)×M=9.6×10-3mol×174g/mol=1.6704g,则样品中Na2S2O4的质量分数为(1.6704g÷2.0g)×100%=83.5%。