【题目】CO2 和CH4是常见的化合物,同时也是常用的化工原料。
Ⅰ.以CO2与NH3为原料可以合成尿素[CO(NH2)2]。合成尿素的反应为2NH3(g) + CO2(g) ![]() CO(NH2)2(s) + H2O(g)。
CO(NH2)2(s) + H2O(g)。
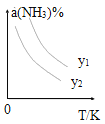
(1)在不同温度及不同y值下合成尿素,达到平衡时,氨气转化率变化情况如图所示。
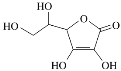
①该反应的ΔH_____0(填“>” 或、“<” ),该反应自发进行的条件是_______________ (填“低温”“高温”或“任意温度”) 若y表示反应开始时的氨碳比[![]() ],则y1________y2。(填“>”、“<”或“=”);
],则y1________y2。(填“>”、“<”或“=”);
(2)t℃时,若向容积固定的密闭容器中加入一定量的 NH3和CO2合成尿素,下列叙述能说明此反应达到平衡状态的是________ (填字母)。
a.混合气体的平均相对分子质量保持不变
b.CO2和NH3的体积分数保持不变
c.CO2和NH3的转化率相等
d.混合气体的密度保持不变
e.1molCO2生成的同时有 2molN—H键断裂
II.工业上用CH4与水蒸气在一定条件下制取H2,:CH4(g) + H2O(g) ![]() CO(g) + 3H2(g) ΔH = + 203 kJmol-1
CO(g) + 3H2(g) ΔH = + 203 kJmol-1
①该反应逆反应速率表达式为:v逆=kc(CO) c3(H2),k 为速率常数,在某温度下测得实验数据如表:
CO浓度(molL-1) | H2浓度(molL-1) | 逆反应速率(molL-1min-1) |
0.05 | c1 | 4.8 |
c2 | c1 | 19.2 |
c2 | 0.1 | 8.1 |
由上述数据可得该温度下,该反应的逆反应速率常数k为____L3mol-3min-1。
②某温度下,在体积为3 L的密闭容器中通入物质的量均为3 mol的CH4和水蒸气,发生上述反应,5分钟时达到平衡,此时H2的体积分数为60%,则在5分钟内用CH4浓度变化表示的平均反应速率v(CH4)=________;该温度下该反应的平衡常数K=________。平衡后再向容器中加入1 mol CH4和1 mol CO,平衡_______移动(填“正反应方向”或“逆反应方向”或“不”)。
III.在常温下,将0.02mol CO2通入200mL 0.15mol/L的NaOH溶液中,充分反应后下列关系式中正确的是_____________________
A.c(Na+)>c(HCO3-)> c(CO32-)>c(OH-)>c(H+)
B.3c (Na+)=2[c(CO32-)+ c(HCO3-)+ c(H2CO3)]
C.c (Na+)+c(H+)=c(HCO3-)+ c(CO32-)+c(OH-)
D.c(HCO3-)+ 3c(H2CO3)+2c(H+)= c(CO32-)+2c(OH-)
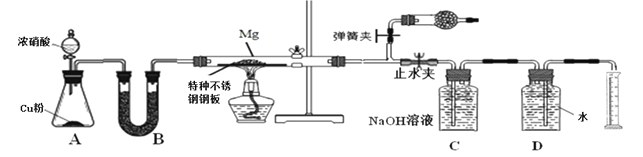
【题目】碱式碳酸铜[Cu(OH)2CuCO3]是一种用途广泛的化工产品,实验室制备碱式碳酸铜的反应原理为:2CuSO4+2Na2CO3+H2O=Cu(OH)2CuCO3↓+CO2↑+2Na2SO4。回答下列问题:
(1)配制100mL浓度均为0.50molL-1的CuSO4溶液和Na2CO3溶液,需要用到的玻璃仪器有量筒、烧杯、胶头滴管和___。
(2)取50mL0.50molL-1CuSO4溶液加入50mL0.50molL-1Na2CO3溶液中,反应后烧杯底部出现大量蓝绿色沉淀。设计实验证明蓝绿色沉淀中混有难溶于水的碱式硫酸铜[Cu2(OH)2SO4],实验步骤是:过滤,___。
(3)按最佳配比 n(CuSO4)︰n(Na2CO3)=1︰1.2进行实验,反应15min,所得实验结果如下:
温度/℃ | 60 | 65 | 75 | 80 | 90 |
沉淀量/g | 1.295 | 1.303 | 1.451 | 1.340 | 1.292 |
分析75℃时沉淀量最多的原因:___。
(4)查阅资料可知碱式碳酸铜的组成有多种,可用xCu(OH)2yCuCO3表示。某小组利用以下装置测定某碱式碳酸铜样品的组成:
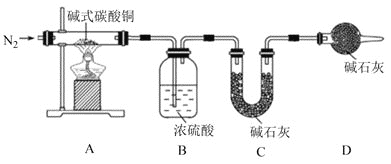
①A中发生反应的化学方程式是___。
②加热时持续通入N2的目的是___。
③称取32.0g样品,充分反应后得到24.0g残留物,B增重3.6g,C增重4.4g。该样品的化学式为___。若对调B和C装置的位置,___(填“能”或“不能”)测算出该样品的化学式。