题目内容
【题目】工业上,通常采用电解法处理酸性废水中的![]() ,装置示意图如图所示。下列说法正确的是
,装置示意图如图所示。下列说法正确的是
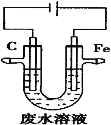
A.石墨极上发生氧化反应
B.阳极的电极反应式为![]()
C.除去![]() 的反应:
的反应:![]()
D.随着电解的进行,石墨极附近电解质溶液的pH会减小
【答案】C
【解析】
由图可知,Fe与电源正极相连,则Fe作阳极,Fe失电子,发生氧化反应生成亚铁离子,石墨为阴极,溶液中氢离子得到电子发生还原反应,且处理酸性废水中的Cr2O72-,发生Cr2O72-+6Fe2++14H+═2Cr3++6Fe3++7H2O,以此来解答。
A.石墨与电源负极相连,为阴极,发生还原反应,故A错误;
B.Fe作阳极,Fe失电子,发生氧化反应生成亚铁离子,阳极反应为Fe-2e-═Fe2+,故B错误;
C.发生Cr2O72-+6Fe2++14H+═2Cr3++6Fe3++7H2O,处理废水,故C正确;
D.阴极发生还原反应,溶液中的氢离子得到电子减少,同时生成氢氧根,pH增大,故D错误;
故选:C。

【题目】用如图装置进行实验;下列预期实验现象及相应结论均正确的是( )

a | b | 预期实验现象 | 结论 | |
A | 铜丝 | 浓硝酸 | 试管c中有大量红棕色气体 | 硝酸有强氧化性 |
B | 木条 | 18.4mol/L硫酸 | 木条变黑 | 浓硫酸有酸性及氧化性 |
C | 生铁 | NaCl溶液 | 导管处发生倒吸 | 生铁发生吸氧腐蚀 |
D | 铁丝 | 含少量HCl的H2O2溶液 | 试管c中有大量无色气体 | 该反应中铁作催化剂 |
A. A B. B C. C D. D
【题目】CO2 和CH4是常见的化合物,同时也是常用的化工原料。
Ⅰ.以CO2与NH3为原料可以合成尿素[CO(NH2)2]。合成尿素的反应为2NH3(g) + CO2(g) ![]() CO(NH2)2(s) + H2O(g)。
CO(NH2)2(s) + H2O(g)。
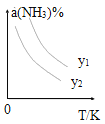
(1)在不同温度及不同y值下合成尿素,达到平衡时,氨气转化率变化情况如图所示。
①该反应的ΔH_____0(填“>” 或、“<” ),该反应自发进行的条件是_______________ (填“低温”“高温”或“任意温度”) 若y表示反应开始时的氨碳比[![]() ],则y1________y2。(填“>”、“<”或“=”);
],则y1________y2。(填“>”、“<”或“=”);
(2)t℃时,若向容积固定的密闭容器中加入一定量的 NH3和CO2合成尿素,下列叙述能说明此反应达到平衡状态的是________ (填字母)。
a.混合气体的平均相对分子质量保持不变
b.CO2和NH3的体积分数保持不变
c.CO2和NH3的转化率相等
d.混合气体的密度保持不变
e.1molCO2生成的同时有 2molN—H键断裂
II.工业上用CH4与水蒸气在一定条件下制取H2,:CH4(g) + H2O(g) ![]() CO(g) + 3H2(g) ΔH = + 203 kJmol-1
CO(g) + 3H2(g) ΔH = + 203 kJmol-1
①该反应逆反应速率表达式为:v逆=kc(CO) c3(H2),k 为速率常数,在某温度下测得实验数据如表:
CO浓度(molL-1) | H2浓度(molL-1) | 逆反应速率(molL-1min-1) |
0.05 | c1 | 4.8 |
c2 | c1 | 19.2 |
c2 | 0.1 | 8.1 |
由上述数据可得该温度下,该反应的逆反应速率常数k为____L3mol-3min-1。
②某温度下,在体积为3 L的密闭容器中通入物质的量均为3 mol的CH4和水蒸气,发生上述反应,5分钟时达到平衡,此时H2的体积分数为60%,则在5分钟内用CH4浓度变化表示的平均反应速率v(CH4)=________;该温度下该反应的平衡常数K=________。平衡后再向容器中加入1 mol CH4和1 mol CO,平衡_______移动(填“正反应方向”或“逆反应方向”或“不”)。
III.在常温下,将0.02mol CO2通入200mL 0.15mol/L的NaOH溶液中,充分反应后下列关系式中正确的是_____________________
A.c(Na+)>c(HCO3-)> c(CO32-)>c(OH-)>c(H+)
B.3c (Na+)=2[c(CO32-)+ c(HCO3-)+ c(H2CO3)]
C.c (Na+)+c(H+)=c(HCO3-)+ c(CO32-)+c(OH-)
D.c(HCO3-)+ 3c(H2CO3)+2c(H+)= c(CO32-)+2c(OH-)





