题目内容
【题目】Fe、C、N、O元素是与生命活动密不可分的元素,请回答下列问题:
(1)“笑气”(N2O)是人类最早应用于医疗的麻醉剂之一。已知N2O分子中氧原子只与一个氮原子相连,则N2O的分子空间构型是________。
(2)另一种常用麻醉剂氯仿常因保存不慎而被氧化,产生剧毒物光气(COCl2):2CHCl3+O2=2HCl+2COCl2,光气(COCl2)分子的空间构型是________。
(3)维生素C是一种水溶性维生素,水果和蔬菜中含量丰富,该物质结构简式如图所示。以下关于维生素C的说法正确的是________(填字母序号)。
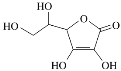
a.分子中既含有极性键又含有非极性键
b.1 mol分子中含有4 mol π键
c.该物质的熔点可能高于NaCl
d.分子中所含元素电负性由大到小的顺序为O>C>H
e.维生素C晶体溶于水的过程中要克服的微粒间作用力只有范德华力
(4)已知尿素的结构简式为H2NCONH2,尿素可用于制有机铁肥,主要代表物有三硝酸六尿素合铁(Ⅲ),化学式为[Fe(H2NCONH2)6](NO3)3。
①基态Fe3+的核外电子排布式为____________。
C、N、O三种元素的第一电离能由大到小的顺序是________。
②尿素分子中C原子和N原子的杂化方式分别是__________。
③[Fe(H2NCONH2)6](NO3)3中H2NCONH2与Fe(+3价)之间的作用力称为__________,与![]() 互为等电子体的一种化合物分子是____________(写化学式)。
互为等电子体的一种化合物分子是____________(写化学式)。
(5)维生素B1可作为辅酶参与糖的代谢,并有保护神经系统的作用。该物质的结构简式为
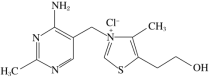
①以下关于维生素B1的说法正确的是________(填字母序号,下同)。
A.只含σ键和π键 B.既有共价键又有离子键
C.该物质的熔点可能高于NaCl D.该物质易溶于盐酸
②维生素B1晶体溶于水的过程中要克服的微粒间作用力有________。
A.离子键、共价键 B.离子键、氢键、共价键
C.氢键、范德华力 D.离子键、氢键、范德华力
【答案】直线形 平面三角形 ad 1s22s22p63s23p63d5或[Ar]3d5 N>O>C sp2、sp3 配位键 SO3或BF3 BD D
【解析】
等电子体是原子总数和价电子总数相等,互为等电子体的物质结构相似,等电子体一般采用原子替换法寻找;利用价层电子对互斥理论和杂化轨道理论确定物质的空间构型和杂化类型;双键中1个σ键和1个π键。
(1)N2O与CO2互为等电子体,故N2O空间构型与CO2相似,为直线形。
(2)COCl2碳原子孤电子对数为![]() =0,价层电子对数为3+0=3,COCl2为平面三角形分子。
=0,价层电子对数为3+0=3,COCl2为平面三角形分子。
(3) 维生素C中含有两个双键,则1 mol维生素C中含有2 mol π键;维生素C分子间能形成氢键,分子间通过氢键和范德华力结合;NaCl通过离子键结合,离子键作用力强,故维生素C熔点低于NaCl;维生素C溶于水破坏范德华力和氢键;故b、c、e不正确,答案选ad。
(4)①Fe的核外电子排布式为1s22s22p63s23p63d64s2或[Ar]3d64s2,失去3个电子得Fe3+的核外电子排布式为1s22s22p63s23p63d5或[Ar]3d5;同周期从左到右第一电离能呈增大的趋势,但氮原子p能级半充满,较稳定,所以C、N、O三种元素的第一电离能由大到小的顺序是N>O>C;
②C原子形成3个σ键,所以C原子采取sp2杂化,N原子形成3个σ键,还有1对孤对电子,其成键电子对数为4,所以N原子采取sp3杂化;
③Fe3+与N原子间以配位键结合,用S替换![]() 中的N原子,得到等电子体SO3;用F替换O,用B替换N,得等电子体BF3。
中的N原子,得到等电子体SO3;用F替换O,用B替换N,得等电子体BF3。
(5)①A.双键含1个σ键和1个π键,其中还有Cl-与N+的离子键,A错误;
B.维生素B1结构中既有共价键又有离子键,B正确;
C.与氯化钠晶体相比,维生素B1中的阳离子比Na+半径大,离子键弱,熔点低,C错误;
D.维生素B1中的—NH2是碱性基团,能与盐酸反应,D正确。
答案选BD。
②维生素B1中含有离子键,水中含有氢键和分子间作用力,维生素B1溶于水时需要克服维生素B1中的离子键、水中的氢键和范德华力,答案选D。

【题目】碱式碳酸铜[Cu(OH)2CuCO3]是一种用途广泛的化工产品,实验室制备碱式碳酸铜的反应原理为:2CuSO4+2Na2CO3+H2O=Cu(OH)2CuCO3↓+CO2↑+2Na2SO4。回答下列问题:
(1)配制100mL浓度均为0.50molL-1的CuSO4溶液和Na2CO3溶液,需要用到的玻璃仪器有量筒、烧杯、胶头滴管和___。
(2)取50mL0.50molL-1CuSO4溶液加入50mL0.50molL-1Na2CO3溶液中,反应后烧杯底部出现大量蓝绿色沉淀。设计实验证明蓝绿色沉淀中混有难溶于水的碱式硫酸铜[Cu2(OH)2SO4],实验步骤是:过滤,___。
(3)按最佳配比 n(CuSO4)︰n(Na2CO3)=1︰1.2进行实验,反应15min,所得实验结果如下:
温度/℃ | 60 | 65 | 75 | 80 | 90 |
沉淀量/g | 1.295 | 1.303 | 1.451 | 1.340 | 1.292 |
分析75℃时沉淀量最多的原因:___。
(4)查阅资料可知碱式碳酸铜的组成有多种,可用xCu(OH)2yCuCO3表示。某小组利用以下装置测定某碱式碳酸铜样品的组成:
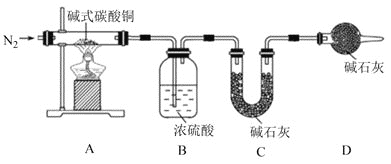
①A中发生反应的化学方程式是___。
②加热时持续通入N2的目的是___。
③称取32.0g样品,充分反应后得到24.0g残留物,B增重3.6g,C增重4.4g。该样品的化学式为___。若对调B和C装置的位置,___(填“能”或“不能”)测算出该样品的化学式。





