题目内容
【题目】下列说法中不正确的是( )
A.ABn型分子中,若中心原子没有孤对电子,则ABn为空间对称结构,属于非极性分子
B.SO3、![]() 、
、![]() 、
、![]() 的空间构型均为三角锥形
的空间构型均为三角锥形
C.NH3、![]() 、H2O、H3O+、CH4中的N、O、C原子均是采取sp3杂化的
、H2O、H3O+、CH4中的N、O、C原子均是采取sp3杂化的
D.配合物[Cu(H2O)4]SO4中,中心离子是Cu2+,配位体是H2O,配位数是4
【答案】B
【解析】
A. ABn型分子中,若中心原子没有孤对电子,则ABn为空间对称结构,正电中心与负电中心重合,属于非极性分子,A正确;
B. SO3、![]() 、
、![]() 、
、![]() 的中心原子孤电子对数分别为0、0、0、1,价层电子对数分别为3、3、3、4,所以SO3、
的中心原子孤电子对数分别为0、0、0、1,价层电子对数分别为3、3、3、4,所以SO3、![]() 、
、![]() 为平面三角形,
为平面三角形,![]() 为三角锥形,B错误;
为三角锥形,B错误;
C. NH3、![]() 、H2O、H3O+、CH4中的N、O、C原子杂化轨道数都是4,均是采取sp3杂化的,只不过NH3、H2O、H3O+中孤对电子占据着杂化轨道,C正确;
、H2O、H3O+、CH4中的N、O、C原子杂化轨道数都是4,均是采取sp3杂化的,只不过NH3、H2O、H3O+中孤对电子占据着杂化轨道,C正确;
D. 配合物[Cu(H2O)4]SO4中,中心离子Cu2+提供空轨道,配位体H2O中氧原子提供孤电子对,形成配位键,配位数是4,D正确。
答案选B。

 七星图书口算速算天天练系列答案
七星图书口算速算天天练系列答案【题目】某化学课外小组用右图装置制取溴苯并探究该反应的类型。先向分液漏斗中加入苯和液溴,再将混合液滴入反应器A(A下端活塞关闭)中。
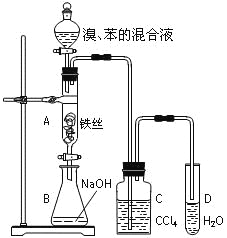
(1)写出A中反应的化学方程式:________________________________________。
(2)实验结束时,打开A下端的活塞,让反应液流入B中,充分振荡,目的是_________________________。
(3)C中盛放CCl4的作用是_____________________________。
(4)若要证明苯和液溴发生的是取代反应,而不是加成反应,通常有两种方法,请按要求填写下表。
向试管D中加入的试剂 | 能证明苯与液溴发生取代反应的现象 | |
方法一 | _____________ | _________________ |
方法二 | _____________ | _________________ |

