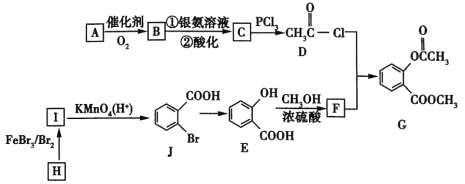
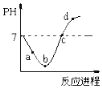
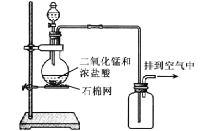
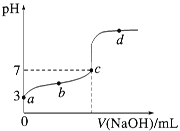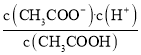【题目】某小组用实验 1验证FeCl3与 Cu的反应,观察到有白色沉淀产生,决定对其进行深入探究。
实验1:
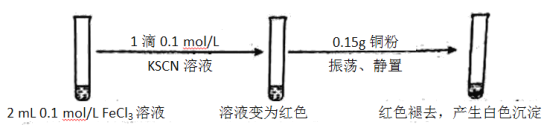
资料:ⅰ. CuSCN、CuCl均为难溶于水的白色固体;均能与硝酸反应,分别生成Cu2+与SO42—、Cu2+与Cl—。
ⅱ. SCN—被称为拟卤素离子,性质与卤素离子相似;(SCN)2性质与溴单质相似,其水溶液呈黄色。
(1)FeCl3溶液与KSCN溶液反应的离子方程式为__________。
(2)下列由实验1得到的推论中,合理的是__________。(填字母序号)
a.Cu能还原Fe3+
b.Fe3+与SCN—的反应是可逆反应
c.白色沉淀中的Cu(Ⅰ)(Ⅰ表示+1 价铜元素)可能是由 Fe3+氧化Cu 得到的
(3)为探究实验1中白色沉淀的成分,小组同学实施了实验2:
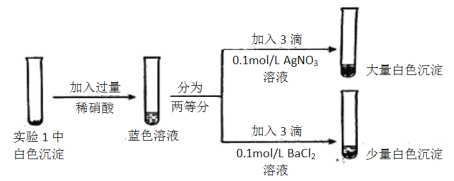
由实验2可知,实验1中白色沉淀的成分是__________。
(4)该小组欲进一步探究实验 1中白色沉淀产生的原因,实施了实验3:
步骤 | 实验操作 | 实验现象 |
Ⅰ | 向2mL 0.1mol/L的FeCl3溶液中加入0.15g Cu粉 | 溶液变为蓝色,澄清透明,底部只有少量红色固体剩余 |
Ⅱ | 取Ⅰ中上层清液于试管中,滴加 1滴 0.1mol/L KSCN溶液 | 有白色沉淀生成,且溶液出现红色 |
Ⅲ | 振荡Ⅱ中试管,静置 | 白色沉淀变多,红色逐渐褪去 |
①步骤Ⅰ中反应的离子方程式为___________________。
②根据实验 3 的现象,小组同学认为 Fe3+与Cu 反应的氧化产物不含Cu(Ⅰ),他们的判断依据是_______________________________。
③步骤Ⅱ中加入KSCN溶液后出现红色的可能原因是______________。
④解释步骤Ⅲ中实验现象产生的可能原因:___________。