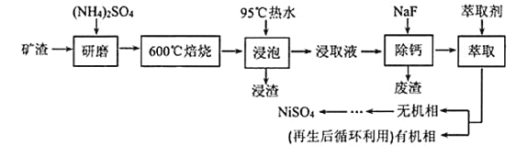
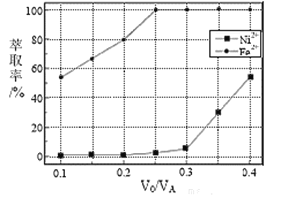
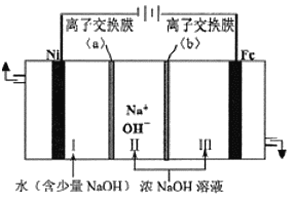
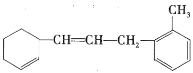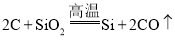��Ŀ����
����Ŀ����֪ij�¶�ʱCH3COOH�ĵ���ƽ�ⳣ��ΪK�����¶�����20 mL 0.1 mol/L CH3COOH��Һ����μ���0.1 mol/L NaOH��Һ����pH�仯������ͼ��ʾ(�����¶ȱ仯)��
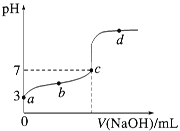
����˵������ȷ����
A.a���ʾ��Һ��c(CH3COO��)ԼΪ10-3mol/L
B.b���ʾ����Һ��c(Na��)��c(CH3COO��)
C.c���ʾCH3COOH��NaOHǡ�÷�Ӧ��ȫ
D.d���ʾ����Һ��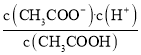 ����K
����K
���𰸡�A
��������
A��a��c��H+��=10-3mol/L�����ڴ���Ϊ���ᣬ��������ˮ�ĵ��룬����ĵ���ԶԶ����ˮ�ĵ��룬������Һ��������Ũ�Ƚ��Ƶ��ڴ��������Ũ�ȣ���c��CH3COO-��ԼΪ10-3mol/L����A��ȷ��
B����Һ��һ���������غ㣺c��Na+��+c��H+��=c��OH-��+c��CH3COO-����b��ʱ����Һ��ʾ���ԣ�c��H+����c��OH-��������c��CH3COO-����c��Na+������B����
C��������������Ʒ�Ӧ���ɴ����ƣ���������ǿ����������ˮ��Һ�ʼ��ԣ������ǡ�÷�Ӧʱ��ҺӦ�óʼ��ԣ���c����Һ�����ԣ�˵�����������C����
D��d��ʱ��Һ���¶�û�б仯������d���ʾ����Һ��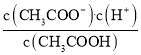 =K����D����
=K����D����
��ѡA��

����Ŀ���ҹ����й�Բ��õĹŴ��Ƽ��������̴����Ѿ������˾ĸ������ش��������⣺
��1��Cu��Ԫ�����ڱ��е�λ��___��Cu2+�ļ۵����Ų�ʽΪ__��
��2����֪��̬ͭ�IJ��ֵ����������ʾ��
������/kJ��mol��1 | I1 | I2 | I3 |
Cu | 746 | 1958 | 2058 |
�ɱ�������֪��I2(Cu)ԶԶ����I1(Cu)����ԭ����__��
��3��Cu2+��������(![]() )��������(
)��������(![]() )�γ�˫����ͭ��
)�γ�˫����ͭ��
��![]() ��C��Nԭ�ӵ��ӻ���Ϊ__��1mol
��C��Nԭ�ӵ��ӻ���Ϊ__��1mol![]() ����__mol������
����__mol������
��˫����ͭCu(![]() )2����λԭ��Ϊ__��
)2����λԭ��Ϊ__��![]() ��Եķе�Ϊ84�棬����(
��Եķе�Ϊ84�棬����(![]() )�ķе���129~131��֮�䣬�����е�ϸߣ���ԭ����__��
)�ķе���129~131��֮�䣬�����е�ϸߣ���ԭ����__��
��4��ijMԭ�ӵ���Χ�����Ų�ʽΪ3s23p5��ͭ��M�γɻ�����ľ�����ͼ��ʾ(�������Mԭ��)��ÿ��ͭԭ����Χ���������ͭԭ����Ŀ__���þ���Ļ�ѧʽΪ__����֪�þ�����ܶ�Ϊ��g��cm��3�������Ħ������ΪMg/mol������٤��������ֵΪNA����þ�����ͭԭ�Ӻ�Mԭ��֮�����̾���Ϊ__pm(ֻд����ʽ)��