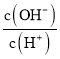题目内容
【题目】(1)浓度为0.1mol/L醋酸钠溶液中质子守恒表达式为_________;
(2)等浓度的NaHCO3 、Na2CO3混合溶液中的物料守恒表达式为__________;
(3)硫代硫酸钠(Na2S2O3)溶液与稀硫酸反应的离子方程式为__________;
(4) Fe2(SO4)3溶液显酸性,用离子方程式表示其原因___________;
(5)常温下,NaHCO3溶液中离子浓度由大到小的顺序是___________________________
(6)在25 ℃下,将a mol·L-1的氨水与0.01 mol·L-1的盐酸等体积混合, 当溶液中c(![]() )=c(Cl-),则溶液显________(填“酸”“碱”或“中”)性;用含a的代数式表示NH3·H2O的电离常数Kb=________。
)=c(Cl-),则溶液显________(填“酸”“碱”或“中”)性;用含a的代数式表示NH3·H2O的电离常数Kb=________。
【答案】c(CH3COOH)+c(H+)=c(OH-) 2c(Na+)=3c(H2CO3)+ 3c(CO32-)+3c(HCO3-) S2O32-+2 H+=S↓+SO2↑+H2O Fe3++3H2O![]() Fe(OH)3+3H+ c(Na +)>c(HCO3-)> c(OH-) >c(H+)>c(CO32-) 中
Fe(OH)3+3H+ c(Na +)>c(HCO3-)> c(OH-) >c(H+)>c(CO32-) 中 ![]()
【解析】
(1) 质子守恒是指酸失去的质子和碱得到的质子数目相同,浓度为0.1mol/L醋酸钠溶液中质子守恒表达式为c(CH3COOH)+c(H+)=c(OH-);
(2)等浓度的NaHCO3 、Na2CO3混合溶液中Na原子和C原子总数之比为3:2,则物料守恒表达式为2c(Na+)=3c(H2CO3)+ 3c(CO32-)+3c(HCO3-);
(3)Na2S2O3与稀H2SO4溶液作用时产生无色有刺激性气体溶液变得浑浊,反应的离子方程式为:S2O32-+2H+═S↓+SO2↑+H2O;
(4) Fe2(SO4)3水解生成氢氧化铁和硫酸,溶液显酸性,用离子方程式表示其原因为Fe3++3H2O ![]() Fe(OH)3+3H+;
Fe(OH)3+3H+;
(5) NaHCO3在溶液中存在水解和电离,水解程度大于电离程度,溶液显碱性,c(OH-) > c (H+),钠离子不水解,HCO3-电离和水电离都生成H+,所以离子浓度关系为c(Na +)>c (HCO3-)> c(OH-) >c (H2CO3)>c(H+)>c(CO32-);
(6)25℃时,混合溶液呈存在电荷守恒c(NH4+)+c(H+)=c(OH-)+c(Cl-),因为存在c(NH4+)=c(Cl-),所以c(H+)=c(OH-),溶液呈中性,所以c(H+)=c(OH-)=10-7 mol/L,混合后溶液体积增大一倍,所以溶液中c(Cl-)=0.005mol/L,c(NH4+)=c(Cl-)=0.005mol/L,c(NH3H2O)=0.5amol/L-c(NH4+)=0.5amol/L-0.005mol/L,Kb=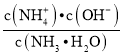 =
=![]() mol/L=
mol/L=![]() mol/L。
mol/L。

 快乐5加2金卷系列答案
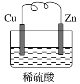
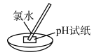
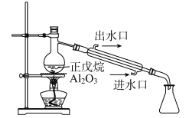
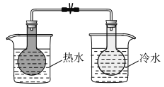
快乐5加2金卷系列答案【题目】为达到下列实验目的,对应的实验方法以及相关解释均正确的是( )
选项 | 实验目的 | 实验方法 | 相关解释 |
A | 测量氯水的pH |
| pH试纸遇酸变红 |
B | 探究正戊烷(C5H12) 催化裂解 |
| C5H12裂解为分子较小的烷烃和烯烃 |
C | 实验温度对平衡移动的影响 |
| 2NO2(g) |
D | 用AlCl3溶液制备AlCl3晶体 |
| AlCl3沸点高于溶剂水 |
A.AB.BC.CD.D