【题目】(1)将一定量的N2(g)和H2(g)放入2L的密闭容器中,在500℃、2×107Pa下发生如下反应:N2(g)+3H2(g) ![]() 2NH3(g)
2NH3(g)
①在反应体系中加入催化剂,该反应的反应热_____(填“增大”、“减小”或“不变”)。
②5分钟后达到平衡,测得N2为0.2 mol,H2为0.6 mol,NH3为0.2 mol。氮气的平均反应速率υ(N2)=___________,H2的转化率为_____________(保留小数点后一位)。
③欲提高②容器中H2的转化率,下列措施可行的是____________。
a.把气体的体积压缩至1L b.向容器中再充入惰性气体
c.改变反应的催化剂 d.液化生成物分离出氨
(2)根据最新“人工固氮”的研究报道,在常温、常压、光照条件下,N2在催化剂(掺有少量Fe2O3和TiO2)表面与水发生下列反应:2N2(g)+6H2O(l)![]() 4NH3(g)+3O2(g) ΔH=akJ/mol,进一步研究NH3生成量与温度关系,常压下达到平衡时测得部分实验数据如下:
4NH3(g)+3O2(g) ΔH=akJ/mol,进一步研究NH3生成量与温度关系,常压下达到平衡时测得部分实验数据如下:
T/K | 303 | 313 | 323 |
NH3生成量/(10-6mol) | 4.8 | 5.9 | 6.0 |
此合成反应的a_________0。(填“大于”、“小于”或“等于”)
【题目】草酸二甲酯可用作制备维生素B13的中间体,也可用作增塑剂。实验室以草酸![]() 和甲醇为原料制备草酸二甲酯的一种方法如下:
和甲醇为原料制备草酸二甲酯的一种方法如下:![]()
![]()
![]() 。
。
相关物质的有关数据如下表所示:
物质 | 苯 | 甲醇 | 草酸二甲酯 |
熔点/℃ | 5.5 | -97 | 54 |
沸点/℃ | 80.1 | 64.3 | 163.5 |
相对分子质量 | 78 | 32 | 118 |
水溶性 | 不溶 | 互溶 | 不溶 |
实验过程:向如图反应装置中加入27g草酸、40g无水甲醇、100ml苯、5ml浓硫酸,搅拌下加热回流;待反应完全后,分离出甲醇和苯,所得反应液经水洗,有机层再用10%的碳酸钠溶液洗涤,然后用蒸馏水洗涤,加无水氯化钙固体干燥;过滤,滤液冷却后析出晶体,干燥,得草酸二甲酯30.1g。
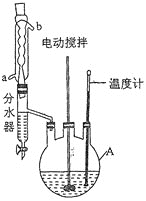
回答下列问题:
(1)仪器A的名称为____________,反应过程中冷却水应从________(填“a”或“b”)口进入。
(2)分离出甲醇和苯的操作名称为______________________________。
(3)用10%的碳酸钠溶液洗涤的目的是____________________________________。
(4)甲醇过量的目的是________________________________________________,浓硫酸的作用是_____________________________________________。
(5)分水器的优点是__________________________________________(任写一点)。
(6)本实验的产率是___________(保留三位有效数字)。
【题目】相同温度下,容积相同的甲、乙、丙3个恒容密闭容器中发生可逆反应:2SO2(g)+O2(g)![]() 2SO3(g)△H=-197kJ/mol。实验测得起始、平衡时的有关数据如下表:
2SO3(g)△H=-197kJ/mol。实验测得起始、平衡时的有关数据如下表:
容器 | 起始各物质的物质的量/mol | 达到平衡时体系能量的变化 | |||
SO2 | O2 | SO3 | Ar | ||
甲 | 2 | 1 | 0 | 0 | 放出热量:Q1 |
乙 | 1.8 | 0.9 | 0.2 | 0 | 放出热量:Q2 |
丙 | 1.8 | 0.9 | 0.2 | 0.1 | 放出热量:Q3 |
下列叙述正确的是
A.若在上述条件下反应生成2molSO3(s)的反应热为△H1,则△H1>-197 kJ·mol-1
B.Q1=Q2=Q3=197kJ
C.甲、乙、丙3个容器中反应的平衡常数不相等
D.达到平衡时,丙容器中SO2的体积分数最小