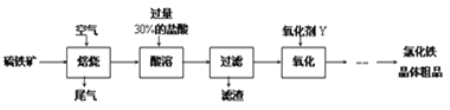
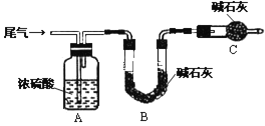
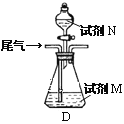
题目内容
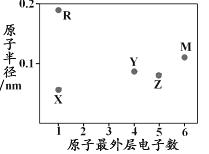
【题目】在体积均为1.0 L的恒容密闭容器中加入足量的相同的碳粉,再分别加入0.1 mol CO2和0.2 mol CO2,在不同温度下反应CO2(g)+C(s)![]() 2CO(g)达到平衡,平衡时CO2的物质的量浓度c(CO2)随温度的变化如图所示(图中Ⅰ、Ⅱ、Ⅲ点均处于曲线上)。下列说法正确的是
2CO(g)达到平衡,平衡时CO2的物质的量浓度c(CO2)随温度的变化如图所示(图中Ⅰ、Ⅱ、Ⅲ点均处于曲线上)。下列说法正确的是

A.化学平衡常数K:K(状态I)<K(状态II)<K(状态III)
B.CO2的平衡转化率α:α(状态I)<α(状态Ⅱ)=α(状态III)
C.体系中c(CO):c (CO,状态Ⅱ)<2c (CO,状态Ⅲ)
D.逆反应速率υ逆:υ逆(状态Ⅰ)>υ逆(状态Ⅲ)
【答案】C
【解析】
A、状态II、III温度相同,K(状态II)=K(状态III),根据图像,升高温度,平衡时c(CO2)减小,平衡正向移动,K增大,K(状态I) <K(状态III),故A错误;
B、状态Ⅰ、III所在曲线是通入0.1molCO2,根据图像,升高温度,平衡时c(CO2)减小,平衡正向移动,故α(状态I)<α(状态III),状态Ⅱ所在曲线是通入0.2molCO2,状态II、III温度相同,状态II相当于在状态III的基础上加压,增大压强,平衡逆向移动,CO2的平衡转化率减小,α(状态Ⅱ)<α(状态III),故B错误;
C、状态III所在曲线是通入0.1molCO2,状态Ⅱ所在曲线是通入0.2molCO2,状态II、III温度相同,状态II相当于在状态III的基础上加压,将体积缩小为原来的一半,增大压强,若平衡不移动,则浓度为2倍,而增大压强,平衡逆向移动,因此c(CO,状态Ⅱ)<2c(CO,状态Ⅲ),故C正确;
D、温度越高,反应速率越快,υ逆(状态Ⅰ)<υ逆(状态Ⅲ),故D错误;
答案选C。

练习册系列答案
 口算题天天练系列答案
口算题天天练系列答案
相关题目