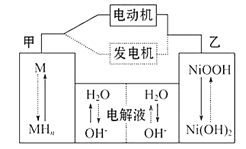
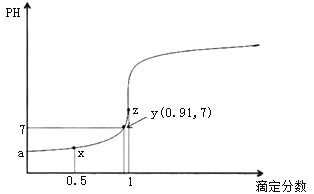
题目内容
【题目】相同温度下,容积相同的甲、乙、丙3个恒容密闭容器中发生可逆反应:2SO2(g)+O2(g)![]() 2SO3(g)△H=-197kJ/mol。实验测得起始、平衡时的有关数据如下表:
2SO3(g)△H=-197kJ/mol。实验测得起始、平衡时的有关数据如下表:
容器 | 起始各物质的物质的量/mol | 达到平衡时体系能量的变化 | |||
SO2 | O2 | SO3 | Ar | ||
甲 | 2 | 1 | 0 | 0 | 放出热量:Q1 |
乙 | 1.8 | 0.9 | 0.2 | 0 | 放出热量:Q2 |
丙 | 1.8 | 0.9 | 0.2 | 0.1 | 放出热量:Q3 |
下列叙述正确的是
A.若在上述条件下反应生成2molSO3(s)的反应热为△H1,则△H1>-197 kJ·mol-1
B.Q1=Q2=Q3=197kJ
C.甲、乙、丙3个容器中反应的平衡常数不相等
D.达到平衡时,丙容器中SO2的体积分数最小
【答案】D
【解析】
乙、丙采用极限法一边倒,SO2、O2的物质的量分别为2mol、1mol,与甲中SO2、O2的物质的量对应相等,恒温恒容条件下,丙中Ar不影响平衡移动,故三者为完全全等的等效平衡,平衡时SO2、O2、SO3的物质的量对应相等;
A、固态转化为气态吸热,即生成固态三氧化硫放热更多,所以若在上述条件下反应生成2molSO3(s)的反应热为△H1,则△H1<-197 kJ·mol-1,A错误;
B、由于平衡时二氧化硫物质的量相等,故参加反应二氧化硫的物质的量:甲>乙=丙,因此放出热量:197kJ>Q1>Q3=Q2,B错误;
B、甲、乙、丙三容器温度相同,平衡常数相同,C错误;
D、由于平衡均是等效的,达到平衡时SO2、O2、SO3的物质的量对应相等,但丙中还有0.1molAr,则丙中二氧化硫的体积分数最小,D正确;
答案选D。
【点晴】
该题的关键是理解等效平衡规律,所谓等效平衡是指外界条件相同时,同一可逆反应只要起始浓度相当,无论经过何种途径,都可以达到相同的平衡状态。等效平衡的判断及处理一般步骤是:进行等效转化——极限法一边倒,即按照反应方程式的计量数之比转化到同一边的量,与题干所给起始投料情况比较。另外该题还需要特别注意丙中稀有气体在恒温恒容条件下不影响平衡移动,注意从本质上理解压强对反应速率和平衡状态的影响。

【题目】草酸二甲酯可用作制备维生素B13的中间体,也可用作增塑剂。实验室以草酸![]() 和甲醇为原料制备草酸二甲酯的一种方法如下:
和甲醇为原料制备草酸二甲酯的一种方法如下:![]()
![]()
![]() 。
。
相关物质的有关数据如下表所示:
物质 | 苯 | 甲醇 | 草酸二甲酯 |
熔点/℃ | 5.5 | -97 | 54 |
沸点/℃ | 80.1 | 64.3 | 163.5 |
相对分子质量 | 78 | 32 | 118 |
水溶性 | 不溶 | 互溶 | 不溶 |
实验过程:向如图反应装置中加入27g草酸、40g无水甲醇、100ml苯、5ml浓硫酸,搅拌下加热回流;待反应完全后,分离出甲醇和苯,所得反应液经水洗,有机层再用10%的碳酸钠溶液洗涤,然后用蒸馏水洗涤,加无水氯化钙固体干燥;过滤,滤液冷却后析出晶体,干燥,得草酸二甲酯30.1g。
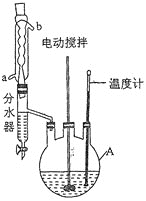
回答下列问题:
(1)仪器A的名称为____________,反应过程中冷却水应从________(填“a”或“b”)口进入。
(2)分离出甲醇和苯的操作名称为______________________________。
(3)用10%的碳酸钠溶液洗涤的目的是____________________________________。
(4)甲醇过量的目的是________________________________________________,浓硫酸的作用是_____________________________________________。
(5)分水器的优点是__________________________________________(任写一点)。
(6)本实验的产率是___________(保留三位有效数字)。
【题目】丙烯酸是合成丙烯酸脂的原料,丙烯醇用于生产甘油、塑料等。某小组以丙烯醛为原料生产丙烯醇、丙烯酸的流程如图所示:
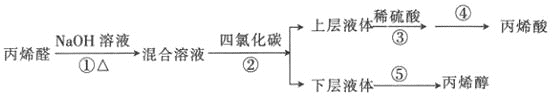 已知反应原理:
已知反应原理:![]()
![]()
有关物质的物理性质如表:
| 丙烯醛 | 丙烯醇 | 丙烯酸 | 四氯化碳 |
沸点/℃ | 53 | 97 | 141 | 77 |
熔点/℃ | -87 | -129 | 13 | -22.8 |
密度/gcm-3 | 0.84 | 0.85 | 1.02 | 1.58 |
溶解性(常温) | 易溶于水和 有机物 | 溶于水和 有机溶剂 | 溶于水和 有机溶剂 | 难溶于水, 易溶于有机物 |
(1)已知苯的沸点为80.1℃,上述步骤②的萃取剂用四氯化碳而不用苯,其主要原因可能是_________________。上层液体分液漏斗________(填“上”或“下”)口倒(或放)出。
(2)从步骤④的残留液中可提取一种无水正盐,它是________(填化学式)。
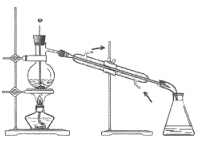
(3)步骤⑤采用如图装置,该装置有一处明显错误,请指出错误:________,并改之。收集丙烯醇的温度应控制在________左右。
(4)已知:醛类具有较强还原性,能与溴水、酸性高锰酸钾溶液、银氨溶液等反应。某同学为了证明丙烯酸产品中含有丙烯醛,设计如下方案:
a.取少量溴水于试管,加入适量丙烯酸样品,振荡,溶液褪色
b.取少量酸性高锰酸钾溶液于试管,加入适量丙烯酸样品,振荡,溶液褪色
c.取少量银氨溶液于试管,加入适量丙烯酸样品,用水浴加热,有银镜产生
d.取少量酸性重铬酸钾溶液于试管,加入适量丙烯酸样品,振荡,溶液由橙红色变成绿色
上述方案中,能证明丙烯酸产品中含少量丙烯醛的是________(填字母)。
(5)请你选择下列药品设计一个简单实验证明丙烯醇含有碳碳双键:________。(可选药品:丙烯醇样品、酸性高锰酸钾溶液、酸性重铬酸钾溶液、溴的四氯化碳溶液和钠粒)
(6)为了证明丙烯酸是弱酸,设计如下方案,其中能达到实验目的的是________(填字母)。
代号 | 方案 | 预测现象 |
A | 取少量 | 溶液变红色 |
B | 常温下,将10ml0.1molL-1NaOH溶液和10ml0.1molL-1 | pH>7 |
C | 用相同的导电仪分别测定盐酸溶液、 | 前者灯泡较亮 |