题目内容
【题目】丙炔酸甲酯![]() 是一种重要的有机化工原料,沸点为103~105℃。实验室制备少量丙炔酸甲酯的反应为:
是一种重要的有机化工原料,沸点为103~105℃。实验室制备少量丙炔酸甲酯的反应为:![]()
![]()
![]() 。装置如下图:
。装置如下图:
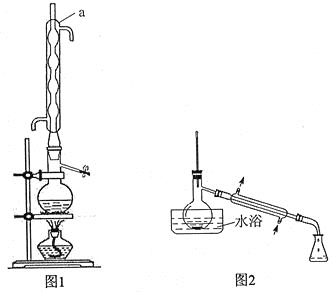
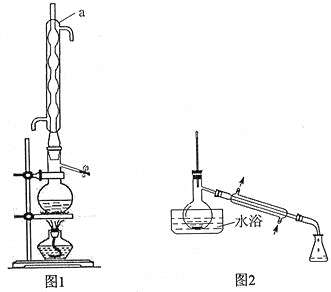
实验步骤如下:
步骤1:在反应瓶中,加入14.0g丙炔酸、50ml甲醇和2ml浓硫酸,少许碎瓷片,加热一段时间(装置见图1)。
步骤2:蒸出过量的甲醇(装置见图2)。
步骤3:反应液冷却后,依次用饱和NaCl溶液、5%Na2CO3溶液、水洗涤。分离出有机相。
步骤4:有机相经无水Na2SO4干燥、过滤、蒸馏,称得丙炔酸甲酯12.5g。
(1)装置图中仪器a的名称是____________,其作用是__________________。
(2)蒸馏烧瓶中加入碎瓷片的目的是____________。若加热后发现未加碎瓷片,应采取的正确方法是____________________________。
(3)步骤1中,加入过量甲醇的目的除作溶剂外,还有________________。
(4)步骤3中,用5%Na2CO3溶液洗涤,主要除去的物质是________________;分离出有机相的操作名称为____________。
(5)步骤4中,蒸馏时不能用水浴加热的原因是______________________________。
(6)本实验的产率是________(保留3位有效数字)。
【答案】球形冷凝管 冷凝回流 防止暴沸 停止加热,待冷却后补加 提高丙炔酸的转化率或提高丙炔酸甲酯的产率 丙炔酸 分液 丙炔酸甲酯的沸点比水的高(或水的沸点是![]() ,比丙炔酸甲酯的沸点低) 74.4%
,比丙炔酸甲酯的沸点低) 74.4%
【解析】
(1)根据装置图确定仪器a的名称及其作用;
(2)蒸馏烧瓶中加入碎瓷片防止暴沸;若加热后发现未加碎瓷片,要将装置冷却至室温后再补加碎瓷片;
(3)酯化反应为可逆反应,加入过量的甲醇,可使平衡正向移动;
(4)丙炔酸具有酸性,可与Na2CO3溶液反应,生成的酯不溶于水,可用分液的方法分离;
(5)丙炔酸甲酯的沸点为103~105℃,比水的沸点高;
(6)根据反应方程式可计算出理论产量,进一步计算出产率。
(1)根据装置图分析可知a为球形冷凝管,其作用为冷凝回流;
(2)液体混合物加热时为防止暴沸通常需要加入碎瓷片;若加热后发现未加碎瓷片,应采取的正确方法是停止加热,待冷却后补加;
(3)酯化反应为可逆反应,甲醇过量,有利于丙炔酸的转化,提高利用率,且甲醇可起到溶剂的作用,即提高丙炔酸的转化率或提高丙炔酸甲酯的产率;
(4)丙炔酸具有酸性,可与碳酸钠溶液反应,则加入饱和碳酸钠溶液可除去丙炔酸;分离出有机相的操作名称为分液;
(5)步骤4中,蒸馏时不能用水浴加热的原因是丙炔酸甲酯的沸点比水的高(或水的沸点是100℃,比丙炔酸甲酯的沸点低);
(6)根据反应可知产物的理论产量为![]() ,所以丙炔酸甲酯的产率为
,所以丙炔酸甲酯的产率为![]() 。
。

 通城学典默写能手系列答案
通城学典默写能手系列答案【题目】醋酸镍 ![]() 是一种重要的化工原料,一种以含镍废料
是一种重要的化工原料,一种以含镍废料![]() 含NiS、
含NiS、![]() 、FeO、CaO、
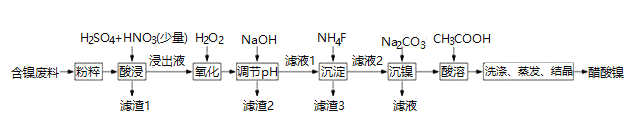
、FeO、CaO、![]() 为原料制取醋酸镍的工艺流程图如下图所示:
为原料制取醋酸镍的工艺流程图如下图所示:
相关离子生成氢氧化物的pH和相关物质的溶解性如表:
金属离子 | 开始沉淀时的pH | 沉淀完全时的pH | 物质 |
|
|
|
|
| 微溶 |
|
|
|
| 可溶 |
|
|
|
| 难溶 |
|
|
|
|
|
![]() 的电子式为_________________。
的电子式为_________________。
![]() 调节pH步骤中,溶液pH的调节范围是_________________。
调节pH步骤中,溶液pH的调节范围是_________________。
![]() 滤渣1和滤渣3主要成分的化学式分别是_________________、_________________。
滤渣1和滤渣3主要成分的化学式分别是_________________、_________________。
![]() 酸浸过程中,lmolNiS失去
酸浸过程中,lmolNiS失去![]() 个电子,同时生成两种无色有毒气体,写出该反应的化学方程式:________。
个电子,同时生成两种无色有毒气体,写出该反应的化学方程式:________。
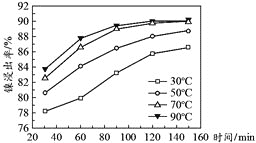
![]() 保持其他条件不变,在不同温度下对含镍废料进行酸浸,镍浸出率随时间变化如下图所示,酸浸的最佳温度与时间分别为_________________。
保持其他条件不变,在不同温度下对含镍废料进行酸浸,镍浸出率随时间变化如下图所示,酸浸的最佳温度与时间分别为_________________。
![]() 沉镍过程中,若
沉镍过程中,若![]() ,欲使100mL该滤液中的
,欲使100mL该滤液中的![]() 沉淀完全
沉淀完全![]() ,则需要加入
,则需要加入![]() 固体的质量最少为___________
固体的质量最少为___________![]() 保留小数点后2位有效数字
保留小数点后2位有效数字![]() 。
。
![]() 近年来镍氢电池发展很快,它可由
近年来镍氢电池发展很快,它可由![]() 跟
跟![]() 中各元素化合价均可看作是零
中各元素化合价均可看作是零![]() 组成:
组成:![]()
![]()
![]() 。该电池放电时,负极反应是________。
。该电池放电时,负极反应是________。
【题目】三盐![]() 可用作聚氯乙烯的热稳定剂,
可用作聚氯乙烯的热稳定剂,![]() 以上开始失去结晶水,不溶于水及有机溶剂。以铅泥
以上开始失去结晶水,不溶于水及有机溶剂。以铅泥![]() 主要成分为PbO、Pb及
主要成分为PbO、Pb及![]() 等
等![]() 为原料制备三盐的工艺流程如图所示。
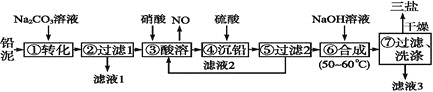
为原料制备三盐的工艺流程如图所示。
已知:![]() 和
和![]() 的溶解度和溶度积Ksp如下表。
的溶解度和溶度积Ksp如下表。
化合物 |
|
|
溶解度 |
|
|
Ksp |
|
|
(1)步骤![]() 转化的目的是___ ,滤液1中的溶质为
转化的目的是___ ,滤液1中的溶质为![]() 和____
和____![]() 填化学式
填化学式![]() 。
。
(2)步骤![]() 酸溶时,为提高酸溶速率,可采取的措施是____
酸溶时,为提高酸溶速率,可采取的措施是____![]() 任写一条
任写一条![]() 。其中铅与硝酸反应生成
。其中铅与硝酸反应生成![]() 和NO的离子方程式为_______。
和NO的离子方程式为_______。
(3)滤液2中可循环利用的溶质的化学式为____。若步骤![]() 沉铅后的滤液中
沉铅后的滤液中![]() ,则此时
,则此时![]() _____
_____![]() 。
。
(4)步骤![]() 合成三盐的化学方程式为__________________。
合成三盐的化学方程式为__________________。