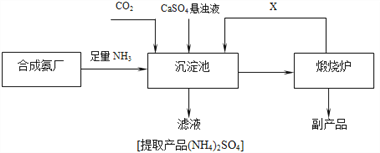
【题目】氨是最重要的化工产品之一,其生产方法也在逐渐改进中,各国科学家均在为提高氨的产量,降低能耗作各种有益的探究;氨在工业上有广泛用途。
(1)合成氨用的H2可以CH4为原料制得。已知相关的化学键键能数据如下:
化学键 | H—H | C—O | C≡O | H—O | C—H |
E/(kJ·mol-1) | 436 | 351 | 1076 | 463 | 413 |
则CH4(g)与H2O(g)反应生成CO(g)和H2(g)的热化学方程式__________。
(2)近年有人将电磁场直接加在氮气与氢气反应的容器内,在较低的温度和压强条件下合成氨,获得了较好的产率。从化学反应本质角度分析,电磁场对合成氨反应的作用是___。
(3)在425℃、A12O3作催化剂,甲醇与氨气反应可以制得(CH3)2NH。(CH3)2NH显弱碱性,与盐酸反应生成(CH3)2NH2Cl,溶液中各离子浓度由小到大的顺序为___。
(4)直接供氨式碱性燃料电池的电池反应式4NH3+3O2=2N2+6H2O,负极电极反应式为___。
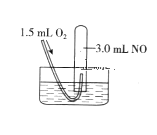
(5)如图,采用NH3作还原剂,烟气以一定的流速通过两种不同催化剂,测量逸出气体中氮氧化物含量,从而确定烟气脱氮率,反应原理为:NO(g)+NO2(g)+2NH3(g)![]() 2N2(g)+3H2O(g)。(注:脱氮率即氮氧化物转化率)
2N2(g)+3H2O(g)。(注:脱氮率即氮氧化物转化率)
①对于气相反应,用某组分(B)的平衡压强(pB)代替物质的量浓度(cB)也可以表示平衡常数(记作KP),则上述反应的表达式KP=_______。
②以下说法正确的是_________。
A.上述反应的正反应为吸热反应
B.相同条件下,改变压强对脱氮率没有影响
C.催化剂①、②分别适合于250℃和450℃左右脱氮
D.曲线①、②最高点表示此时平衡转化率最高
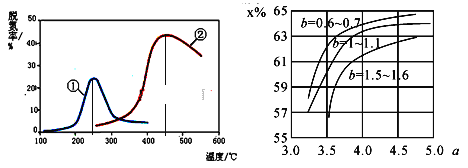
(6)氨气制取尿素的合成塔中发生反应:2NH3(g)+CO2(g)![]() CO(NH2)2(l)+H2O(g)。图中为合成塔中不同氨碳比a和水碳比b时二氧化碳转化率(x%),a宜控制在4.0左右,理由是__________。
CO(NH2)2(l)+H2O(g)。图中为合成塔中不同氨碳比a和水碳比b时二氧化碳转化率(x%),a宜控制在4.0左右,理由是__________。
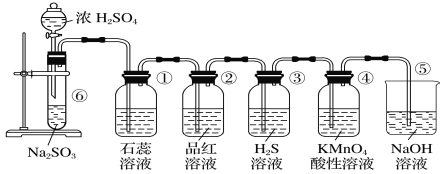
【题目】某实验小组用100mL0.50mol/LNaOH溶液与60mL0.50mol/L硫酸进行中和热的测定。装置如图所示,回答下列问题:
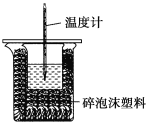
(1)若实验共需要400mLNaOH溶液,实验室在配制该溶液时,则需要称量NaOH固体____g。
(2)图中装置缺少的仪器是____。
(3)硫酸稍过量的原因是____。
(4)请填写下表中的平均温度差:
实验 次数 | 起始温度T1/℃ | 终止温度 T2/℃ | 平均温度差 (T2-T1)/℃ | ||
HCl | NaOH | 平均值 | |||
1 | 26.2 | 26.0 | 26.1 | 30.1 | ____ |
2 | 27.0 | 27.4 | 27.2 | 33.3 | |
3 | 25.9 | 25.9 | 25.9 | 29.8 | |
4 | 26.4 | 26.2 | 26.3 | 30.4 | |
(5)近似认为0.50 mol/L NaOH溶液与0.50 mol/L硫酸溶液的密度都是1 g/cm3,中和后生成溶液的比热容为c=4.18J/(g℃)则上述实验中和热ΔH=___(取小数点后一位)
(6)上述实验结果与57.3kJ/mol有偏差产生偏差的原因可能是____
A.量取NaOH溶液时仰视读数
B.为了使反应充分,可以向酸中分次加入碱
C.实验装置保温隔热效果差
D.用铜丝代替玻璃棒搅拌