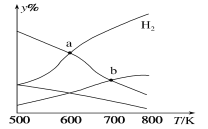
题目内容
【题目】(1)15.6gNa2X中含Na+0.4mol,则Na2X的摩尔质量是________。
(2)设NA为阿伏加德罗常数的数值,如果ag氧气中含有的分子数为b,则cg氧气在标准状况下的体积约是_______(用含NA的式子表示)。
(3)某溶液由Mg2+、Al3+、Cl-、SO42-四种离子组成,测得其中Al3+、SO42-、Cl-的物质的量浓度之比为3:1:13,则溶液中Mg2+、Al3+、SO42-的物质的量浓度之比为___。
(4)奥运金牌“金镶玉”环形碧玉由昆仑玉制成,昆仑玉的成分可简单看成是Ca2Mg5Si8O22(OH)2,则其用氧化物的形式可表示为_______。
(5)下列各项与胶体性质无关的有________。
①卤水点豆腐 ②明矾净水 ③静电除尘 ④油水分离 ⑤血液透析 ⑥三角洲形成 ⑦酸碱中和 ⑧雨后彩虹和海市蜃楼 ⑨臭氧消毒
(6)CaH2的电子式:___。
【答案】78g/mol ![]() L 3:3:1 2CaO5MgO8SiO2H2O ④⑦⑨ [H:]-Ca2+[:H]-
L 3:3:1 2CaO5MgO8SiO2H2O ④⑦⑨ [H:]-Ca2+[:H]-
【解析】
(1)根据盐的组成,由Na+的物质的量计算Na2X的物质的量,再根据n=![]() 计算物质的摩尔质量;
计算物质的摩尔质量;
(2)先计算出cg氧气含有的分子数目,根据n=![]() 确定气体的物质的量,最后根据V=nVm计算气体在标准状况下的体积;
确定气体的物质的量,最后根据V=nVm计算气体在标准状况下的体积;
(3)根据电荷守恒计算溶液中含有Al3+的物质的量,由于溶液的体积相同,所以微粒的物质的量的比等于它们的浓度比;
(4)用氧化物形式表示硅酸盐时,先写金属氧化物,再写非金属氧化物,最后写水,各种元素原子个数比不变;
(5)根据胶体能够发生丁达尔效应、电泳、聚沉等性质分析判断;
(6)CaH2是离子化合物,Ca2+与H-通过离子键结合,据此分析解答。
(1) Na2X中含有2个Na+,则由Na+0.4mol可推知n(Na2X)=0.2mol,由于n=![]() ,所以Na2X的摩尔质量M=
,所以Na2X的摩尔质量M=![]() =78g/mol;
=78g/mol;
(2)ag氧气中含有的分子数为b,则cg氧气中含有的分子数目为N=![]() ,氧气的物质的量为n=
,氧气的物质的量为n= =
=![]() mol,所以该氧气在标准状况下的体积V=n·Vm=
mol,所以该氧气在标准状况下的体积V=n·Vm=![]() mol×22.4L/mol=
mol×22.4L/mol=![]() L;
L;
(3)某溶液中Mg2+、Al3+、Cl-、SO42-四种离子组成,其中Al3+、SO42-、Cl-的物质的量浓度之比为3:1:13,根据电荷守恒可知:2c(Mg2+)+3c(Al3+)=2c(SO42-)+c(Cl-),所以c(Mg2+)=3mol/L,因此溶液中Mg2+、Al3+、SO42-的物质的量浓度之比为3:3:1;
(4)某昆仑玉的成分可简单看成是Ca2Mg5Si8O22(OH)2,则根据氧化物表示原则,其用氧化物的形式可表示为2CaO5MgO8SiO2H2O;
(5)①蛋白质溶液属于胶体,滴入卤水,其中的电解质电离产生的离子中和胶粒的电荷,使蛋白质聚集形成沉淀,与溶剂水分离,得到豆腐,是胶体的聚沉,与胶体有关;
②明矾水解产生的氢氧化铝胶体吸附水中悬浮的固体颗粒,形成沉淀,从而具有净水作用,与胶体有关;
③胶体的胶粒带有电荷,在外加电场力作用下,胶粒向某一个电极定向移动,从而使空气净化,所以静电除尘与胶体有关;
④油水分离是油与水互不相溶,且油的密度比水小的性质,与胶体无关;
⑤血液透析是根据胶粒直径比半透膜缝隙的直径大而除去血液中毒素,与胶体有关;
⑥三角洲形成是土壤胶体的胶粒遇到海水中的电解质发生的聚沉现象,与胶体有关;
⑦酸碱中和是酸电离产生的H+与碱电离产生的OH-中和形成H2O,与胶体无关;
⑧雨后彩虹和海市蜃楼是水滴在空气中形成的胶体对光线的散射作用,与胶体有关;
⑨臭氧消毒是O3具有强的氧化性作用的结果,与胶体无关;
综上所述可知:与胶体无关的是④⑦⑨;
(5)CaH2是Ca2+与H-通过离子键结合形成的离子化合物,该物质的电子式为:[H:]-Ca2+[:H]-。

【题目】以冶炼金属铝的废弃物铝灰为原料制取超细α-氧化铝,既能降低环境污染又可提高铝资源的利用率。已知铝灰的主要成分为A12O3(含少量杂质SiO2、FeO、Fe2O3),其制备流程如下:

(1)用上图中“滤渣”和NaOH焙烧制备硅酸钠,可采用的装置为_____(填选项编号)。

(2)流程中加入H2O2有气体产生,原因是___________________________________。
(3)通过调节溶液的pH来“沉铁”,得到Fe(OH)3.已知:
Fe3+ | Fe2+ | Al3+ | |
开始沉淀时的pH | 2.2 | 7.5 | 3.7 |
完全沉淀时的pH | 3.2 | 9.0 | 4.7 |
为保证产品的纯度,可以选用下列物质中的_______调节溶液pH(填字母),调节pH的范围为______________。
a.Al2O3 b.NaOH c.Al(OH)3 d.Na2CO3
(4)煅烧硫酸铝铵晶体,发生的主要反应为:4[NH4Al(SO4)212H2O]![]() 2Al2O3+2NH3↑+N2↑+5SO3↑+3SO2↑+53H2O,将产生的气体通过下图所示的装置:
2Al2O3+2NH3↑+N2↑+5SO3↑+3SO2↑+53H2O,将产生的气体通过下图所示的装置:

①集气瓶中收集到的气体是____________(填化学式)。
②装有KMnO4溶液洗气瓶的作用是____________________________。
③选用一种常用化学试剂和稀硝酸检验硫酸铝铵,该试剂_________。写出硫酸铝铵加入足量该试剂的离子方程式__________________________________________________。
④20℃时,0.1mol·L-1硫酸铝铵,其溶液pH=3,则溶液中,2c(SO42-)-c(NH4+)-3c(Al3+)=____________mol·L-1(填具体数字计算式,不必化简)