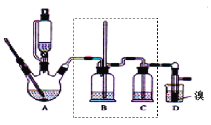
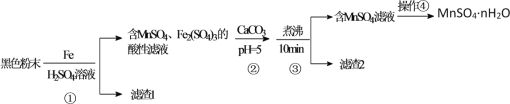【题目】实验室制备1,2-二溴乙烷,可用足量的乙醇先制备乙烯,再用乙烯和少量的溴制备1,2-二溴乙烷,装置如下图所示:
有关数据列表如下:
乙醇 | 1,2-二溴乙烷 | 乙醚 | |
状态 | 无色液体 | 无色液体 | 无色液体 |
密度/g·cm-3 | 0.79 | 2.2 | 0.71 |
沸点/℃ | 78.5 | 132 | 34.6 |
熔点/℃ | -130 | 9 | -116 |
回答下列问题:
(1)在此制备实验中,要尽可能迅速地把反应温度提高到170℃左右,其最主要目的是____;(填正确选项前的字母)
a.引发反应 b.加快反应速度 c.防止乙醇挥发 d.减少副产物乙醚生成
(2)在装置A中除了浓硫酸和乙醇外,还应加入___,其目的是_____,装置A中生成副产物乙醚的化学反应方程式 ______。
(3)实验室制取乙烯,常因温度过高而使乙醇和浓H2SO4反应生成少量的二氧化硫,为了验证二氧化硫的存在并除去二氧化硫对后续反应的干扰,某同学在A和D之间加入了B、C两个装置,其中B和C中可分别盛放_____
a.酸性KMnO4和水 b.品红和NaOH溶液
c.酸性KMnO4和NaOH溶液 d.品红和酸性KMnO4
(4)将1,2-二溴乙烷粗产品置于分液漏斗中加水,振荡后静置,产物应在____层(填“上”、“下”);若产物中有少量副产物乙醚。可用_____的方法除去。
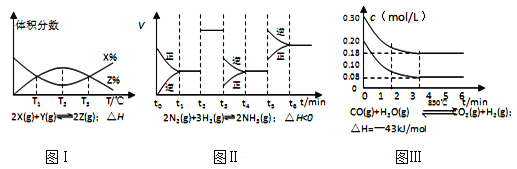
【题目】X、Y、Z、W为按原子序数由小到大排列的四种短周期元素,已知:![]() 元素原子价电子排布式为
元素原子价电子排布式为![]() ,且原子半径是同族元素中最小的。
,且原子半径是同族元素中最小的。![]() 元素是地壳中含量最多的元素;W元素的电负性略小于Y元素,在W原子的电子排布中,p轨道上只有一个未成对电子。
元素是地壳中含量最多的元素;W元素的电负性略小于Y元素,在W原子的电子排布中,p轨道上只有一个未成对电子。![]() 元素的电离能数据如表
元素的电离能数据如表![]() :
:
|
|
|
|
|
496 | 4562 | 6912 | 9540 |
|
请回答:
![]() 的电子式为______,含有的化学键类型为______,
的电子式为______,含有的化学键类型为______,![]() 为______晶体。
为______晶体。
![]() 遇水发生强烈水解产生一种气体A,溶液呈碱性,则A的结构式为______,其分子空间构型为______。
遇水发生强烈水解产生一种气体A,溶液呈碱性,则A的结构式为______,其分子空间构型为______。
![]() 、Y、Z、W四种元素所形成的单质中,硬度最大的是______
、Y、Z、W四种元素所形成的单质中,硬度最大的是______![]() 填物质的名称
填物质的名称![]() ;晶体
;晶体![]() 明显高的原因是______;
明显高的原因是______;![]() 中X原子的杂化轨道类型为______。
中X原子的杂化轨道类型为______。
![]() 晶体的结构示意图如图所示。设该晶体的摩尔质量为
晶体的结构示意图如图所示。设该晶体的摩尔质量为![]() ,晶体的密度为
,晶体的密度为![]() 阿伏加德罗常数为
阿伏加德罗常数为![]() ,则晶体中两个最近的Z离子中心间的距离
,则晶体中两个最近的Z离子中心间的距离![]() ______。
______。
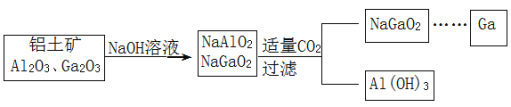
【题目】以黄铁矿为原料制硫酸产生的硫酸渣中含Fe2O3、SiO2、Al2O3、MgO等,用硫酸渣制备铁红(Fe2O3)的过程如图所示:
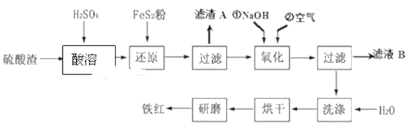
回答下列问题:
(1)酸溶时,粉碎硫酸渣的目的是__________
(2)还原过程中加入FeS2粉增大溶液中Fe2+的含量,同时有H2SO4生成,完成该反应的离子方程式:FeS2+14Fe3++______H2O═15Fe2++______SO42-+______.______________
(3)滤渣A的主要成分为__________
(4)生产过程中,为了确保铁红的纯度,氧化过程需要调节溶液的pH的范围是_____;(部分阳离子以氢氧化物形式沉淀时溶液的pH见表)
沉淀物 | Fe(OH)3 | Al(OH)3 | Fe(OH)2 | Mg(OH)2 |
开始沉淀pH | 2.7 | 3.8 | 7.5 | 9.4 |
完全沉淀pH | 3.2 | 5.2 | 9.7 | 12.4 |
为得到纯净的Fe(OH)3固体,需要对沉淀进行洗涤,判断沉淀Fe(OH)3是否洗净的方法是__________。