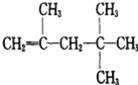
题目内容
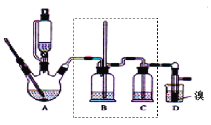
【题目】实验室制备1,2-二溴乙烷,可用足量的乙醇先制备乙烯,再用乙烯和少量的溴制备1,2-二溴乙烷,装置如下图所示:
有关数据列表如下:
乙醇 | 1,2-二溴乙烷 | 乙醚 | |
状态 | 无色液体 | 无色液体 | 无色液体 |
密度/g·cm-3 | 0.79 | 2.2 | 0.71 |
沸点/℃ | 78.5 | 132 | 34.6 |
熔点/℃ | -130 | 9 | -116 |
回答下列问题:
(1)在此制备实验中,要尽可能迅速地把反应温度提高到170℃左右,其最主要目的是____;(填正确选项前的字母)
a.引发反应 b.加快反应速度 c.防止乙醇挥发 d.减少副产物乙醚生成
(2)在装置A中除了浓硫酸和乙醇外,还应加入___,其目的是_____,装置A中生成副产物乙醚的化学反应方程式 ______。
(3)实验室制取乙烯,常因温度过高而使乙醇和浓H2SO4反应生成少量的二氧化硫,为了验证二氧化硫的存在并除去二氧化硫对后续反应的干扰,某同学在A和D之间加入了B、C两个装置,其中B和C中可分别盛放_____
a.酸性KMnO4和水 b.品红和NaOH溶液
c.酸性KMnO4和NaOH溶液 d.品红和酸性KMnO4
(4)将1,2-二溴乙烷粗产品置于分液漏斗中加水,振荡后静置,产物应在____层(填“上”、“下”);若产物中有少量副产物乙醚。可用_____的方法除去。
【答案】d 碎瓷片(或沸石) 防爆沸 2CH3CH2OH![]() CH3CH2OCH2CH3+H2O b 下 蒸馏
CH3CH2OCH2CH3+H2O b 下 蒸馏
【解析】
(1)乙醇和浓硫酸在140℃时发生分子间脱水;
(2)给液体加热要防止液体瀑沸;乙醇发生分子之间脱水生成乙醚;装置A中生成副产物乙醚的化学反应方程式C2H5OH+C2H5OH![]() C2H5OC2H5+H2O;
C2H5OC2H5+H2O;
(3)利用二氧化硫的漂白性、酸性氧化物及还原性分析;
(4)根据1,2-二溴乙烷和水的密度相对大小解答;利用1,2-二溴乙烷与乙醚的沸点不同进行解答。
(1)乙醇和浓硫酸在140℃的条件下,发生分子内脱水,生成乙醚,故答案为d;
(2)给液体加热加碎瓷片,可以防止液体暴沸;
(3)检验SO2气体常用品红溶液,除去SO2气体可选择酸性KMnO4溶液或NaOH溶液,因乙烯也能被酸性KMnO4溶液氧化,只能选择NaOH溶液,选项b正确,故答案为b;
(4)1,2-二溴乙烷和水不互溶,1,2-二溴乙烷密度比水大,产物应在下层;1,2-二溴乙烷与乙醚的沸点不同,两者均为有机物,互溶,用蒸馏的方法将它们分离。

【题目】在2 L的密闭容器内,800℃时反应2NO(g)+O2(g)2NO2(g)体系中,n(NO)随时间的变化如表:
时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)(mol) | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(1)写出该反应的平衡常数表达式:K=___________________________。已知:K300℃>K350℃,则该反应是______热反应。
(2)下图表示NO2变化的曲线是____。用O2表示从0~2 s内该反应的平均速率v=_________。

(3)能说明该反应已达到平衡状态的是________。
a.v(NO2)=2v(O2) b.容器内压强保持不变
c.v逆(NO)=2v正(O2) d.容器内密度保持不变
(4)为使该反应的反应速率增大,且平衡向正反应方向移动的是________。
a.及时分离出NO2气体 b.适当升高温度
c.增大O2的浓度 d.选择高效催化剂