题目内容
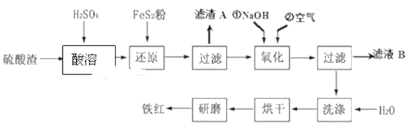
【题目】以黄铁矿为原料制硫酸产生的硫酸渣中含Fe2O3、SiO2、Al2O3、MgO等,用硫酸渣制备铁红(Fe2O3)的过程如图所示:
回答下列问题:
(1)酸溶时,粉碎硫酸渣的目的是__________
(2)还原过程中加入FeS2粉增大溶液中Fe2+的含量,同时有H2SO4生成,完成该反应的离子方程式:FeS2+14Fe3++______H2O═15Fe2++______SO42-+______.______________
(3)滤渣A的主要成分为__________
(4)生产过程中,为了确保铁红的纯度,氧化过程需要调节溶液的pH的范围是_____;(部分阳离子以氢氧化物形式沉淀时溶液的pH见表)
沉淀物 | Fe(OH)3 | Al(OH)3 | Fe(OH)2 | Mg(OH)2 |
开始沉淀pH | 2.7 | 3.8 | 7.5 | 9.4 |
完全沉淀pH | 3.2 | 5.2 | 9.7 | 12.4 |
为得到纯净的Fe(OH)3固体,需要对沉淀进行洗涤,判断沉淀Fe(OH)3是否洗净的方法是__________。
【答案】增大接触面积,加快溶解速率 FeS2+14Fe3++8H2O=15Fe2++2SO42-+16H+ SiO2 3.2~3.8 取少量最后一次洗涤液于洁净的试管中,滴加少量BaCl2溶液,若无明显现象,则沉淀已洗净
【解析】
Fe2O3、MgO为碱性氧化物,SiO2为酸性氧化物,Al2O3为两性氧化物,Fe2O3、MgO、Al2O3与硫酸反应,生成可溶的Fe2(SO4)3、Al2(SO4)3、MgSO4,根据问题(2),加入FeS2,将Fe3+还原成Fe2+,过滤后,向滤液中通入空气,将Fe2+氧化成Fe3+,加入NaOH,调节pH,使Fe3+以Fe(OH)3形式沉淀出来,然后经过过滤、烘干、研磨得到铁红;
(1)粉碎硫酸渣的目的是增大硫酸渣与硫酸的接触面积,加快溶解速率,提高原料的浸出率;
(2)FeS2中S的化合价由-1价→+6价,化合价升高7价,FeS2整体升高14价,Fe3+作氧化剂,化合价降低1价,最小公倍数为14,Fe3+系数为14,FeS2系数为1,SO42-系数为2,根据原子守恒、电荷守恒,离子方程式为FeS2+14Fe3++8H2O=15Fe2++2SO42-+16H+;
(3) Fe2O3、MgO为碱性氧化物,SiO2为酸性氧化物,Al2O3为两性氧化物,Fe2O3、MgO、Al2O3与硫酸反应,生成可溶的Fe2(SO4)3、Al2(SO4)3、MgSO4,SiO2不与稀硫酸反应,即滤渣1为SiO2;
(4)根据上述分析,让Fe3+以Fe(OH)3形式沉淀出来,而Mg2+、Al3+不能沉淀,即pH控制在3.2~3.8之间;Fe(OH)3表面沾有Na2SO4,需要检验SO42-,具体操作是:取少量最后一次洗涤液于洁净的试管中,滴加少量BaCl2溶液,若无明显现象,则沉淀已洗净。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
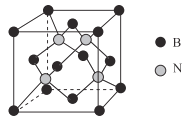
小学生10分钟应用题系列答案【题目】X、Y、Z、W为按原子序数由小到大排列的四种短周期元素,已知:![]() 元素原子价电子排布式为
元素原子价电子排布式为![]() ,且原子半径是同族元素中最小的。
,且原子半径是同族元素中最小的。![]() 元素是地壳中含量最多的元素;W元素的电负性略小于Y元素,在W原子的电子排布中,p轨道上只有一个未成对电子。
元素是地壳中含量最多的元素;W元素的电负性略小于Y元素,在W原子的电子排布中,p轨道上只有一个未成对电子。![]() 元素的电离能数据如表
元素的电离能数据如表![]() :
:
|
|
|
|
|
496 | 4562 | 6912 | 9540 |
|
请回答:
![]() 的电子式为______,含有的化学键类型为______,
的电子式为______,含有的化学键类型为______,![]() 为______晶体。
为______晶体。
![]() 遇水发生强烈水解产生一种气体A,溶液呈碱性,则A的结构式为______,其分子空间构型为______。
遇水发生强烈水解产生一种气体A,溶液呈碱性,则A的结构式为______,其分子空间构型为______。
![]() 、Y、Z、W四种元素所形成的单质中,硬度最大的是______
、Y、Z、W四种元素所形成的单质中,硬度最大的是______![]() 填物质的名称
填物质的名称![]() ;晶体
;晶体![]() 明显高的原因是______;
明显高的原因是______;![]() 中X原子的杂化轨道类型为______。
中X原子的杂化轨道类型为______。
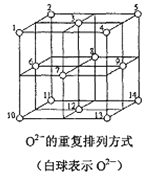
![]() 晶体的结构示意图如图所示。设该晶体的摩尔质量为
晶体的结构示意图如图所示。设该晶体的摩尔质量为![]() ,晶体的密度为
,晶体的密度为![]() 阿伏加德罗常数为
阿伏加德罗常数为![]() ,则晶体中两个最近的Z离子中心间的距离
,则晶体中两个最近的Z离子中心间的距离![]() ______。
______。
【题目】在一定温度下,将气体X和气体Y各0.16mol充入10L恒容密闭容器中,发生反应X(g)+Y(g)![]() 2Z(g)ΔH<0,一段时间后达到平衡。反应过程中测定的数据如表
2Z(g)ΔH<0,一段时间后达到平衡。反应过程中测定的数据如表
t/min | 2 | 4 | 7 | 9 |
n(Y)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
下列说法不正确的是
A.反应前2min的平均速率v(Z)=2.0×10-3mol/(L·min)
B.其他条件不变,升高温度,反应达到新平衡前v(逆)>v(正)
C.该温度下此反应的平衡常数K=1.44
D.其他条件不变,再充入0.2molZ,平衡时X的体积分数不变
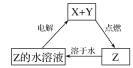
【题目】实验室用环己醇脱水的方法合成环己烯,该实验的装置如图所示:可能用到的有关数据如下:

相对分子质量 | 密度/(g·cm-3) | 沸点/℃ | 溶解性 | |
环己醇 | 100 | 0.9618 | 161 | 微溶于水 |
环己烯 | 82 | 0.8102 | 83 | 难溶于水 |
按下列实验步骤回答问题:
Ⅰ.产物合成:在a中加入10.0g环己醇和2片碎瓷片,冷却搅拌下慢慢加入1mL浓硫酸,b中通入冷却水后,开始缓慢加热a,控制馏出物的温度接近90℃。
(1)碎瓷片的作用是___;a的名称是__;
(2)a中发生主要反应的化学方程式为___;本实验最容易产生的有机副产物的结构简式为___。
Ⅱ.分离提纯:将反应粗产物倒入分液漏斗中,依次用少量5%碳酸钠溶液和水洗涤,分离后加入无水氯化钙颗粒,静置一段时间后弃去氯化钙,最终通过操作X得到纯净的环己烯,称量,其质量为6.15g。
(3)用碳酸钠溶液洗涤的作用是___,操作X的名称为___。
Ⅲ.产物分析及产率计算:
(4)①核磁共振氢谱可以帮助鉴定产物是否为环己烯,环己烯分子中有__种不同化学环境的氢原子。②本实验所得环己烯的产率是___。