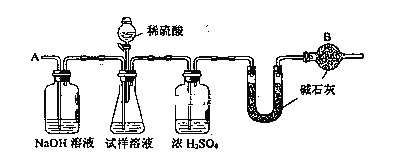
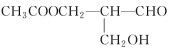【题目】铁是应用最广泛的金属,铁的卤化物、氧化物以及高价铁的含氧酸盐均为重要化合物。
(1)高铁酸钾(K2FeO4)是一种强氧化剂,可作为水处理剂和高容量电池材料。FeCl3与KClO在强碱性条件下反应可制取K2FeO4。其反应的离子方程式:Fe(OH)3+ClO-+OH-→FeO42-+H2O+Cl-(未配平)。配平上述离子方程式,用单线桥法标出电子转移方向和数目。___
___Fe(OH)3+___ClO-+___OH-→___FeO42-+___H2O+___Cl-
该反应中,还原剂是___,被还原的元素是___。
(2)在一定温度下,氧化铁可以与一氧化碳发生反应:Fe2O3(s)+3CO(g)![]() 2Fe(s)+3CO2(g)+Q。
2Fe(s)+3CO2(g)+Q。
已知该反应在不同温度下的平衡常数如表。
温度/℃ | 1000 | 1150 | 1300 |
平衡常数 | 64.0 | 50.7 | 42.9 |
该反应的平衡常数表达式为___,Q__0(填“>”、“<”或“=”)。
(3)在容积为10L的密闭容器中,1000℃时加入Fe、Fe2O3、CO、CO2各1.0mol,反应经过10min后达到平衡,该时间范围内反应的平均反应速率v(CO2)=___,CO的平衡转化率为____。
(4)欲提高CO的平衡转化率,可采取的措施是___。
A.减少Fe的量 B.增加Fe2O3的量
C.移出部分CO2 D.提高反应温度
E.减小容器的容积 F.加入合适的催化剂
(5)现在恒压密闭容器中通入1molH2和1molCO2发生反应:CO(g)+H2O(g)![]() CO2(g)+H2(g)+41kJ。当反应达到平衡后,在其他条件不变时,再通入1molH2和1molCO2的混合气体,请在图中画出正(v正)、逆(v逆)反应速率随时间t变化的示意图。___
CO2(g)+H2(g)+41kJ。当反应达到平衡后,在其他条件不变时,再通入1molH2和1molCO2的混合气体,请在图中画出正(v正)、逆(v逆)反应速率随时间t变化的示意图。___

【题目】决定物质性质的重要因素是物质结构。请回答下列问题:
(1)元素K的焰色反应呈紫红色,其中紫色对应的辐射波长为_______nm(填标号)。
A.404.4 B.553.5 C.589.2 D.670.8 E.766.5
(2)基态K原子中,核外电子占据最高能层的符号是________,占据该能层电子的电子云轮廓图形状为________________。
(3)已知元素M是组成物质Ca5(PO4)3F的一种元素。元素M的气态原子逐个失去第1个至第5个电子所需能量(即电离能,用符号I1至I5表示)如表所示:
I1 | I2 | I3 | I4 | I5 | |
电离能(kJ/mol) | 589.8 | 1145.4 | 4912.4 | 6491 | 8153 |
元素M化合态常见化合价是________价,其基态原子电子排布式为____________
(4)PO43-的中心原子的杂化方式为__________,键角为_______________
(5)Ca3(PO4)3F中非金属元素电负性由大到小的顺序为________________
(6)下列元素或化合物的性质变化顺序正确的是__________________
A.第一电离能:Cl>S>P>Si B.共价键的极性:HF>HCI>HBr>HI
C.晶格能:NaF>NaCl>NaBr>NaI D.热稳定性:MgCO3>CaCO3>SrCO3>BaCO3
(7)CaF2晶胞结构如图所示,则CaF2晶体中与Ca2+最近且等距离的Ca2+数目为_____________;已知Ca2+和F-半径分别为a cm、b cm,阿伏加德罗常数为NA,M为摩尔质量,则晶体密度为___________________g·cm-3(不必化简)。