题目内容
【题目】铁铬氧化还原液流电池是一种低成本的储能电池,电池结构如图所示,工作原理为Fe3++Cr2+![]() Fe2++Cr3+。下列说法一定正确的是
Fe2++Cr3+。下列说法一定正确的是
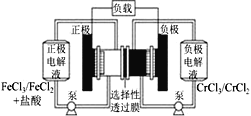
A.放电时,正极的电极反应式为Cr2+-e-=Cr3+
B.电池充电时,阴极的电极反应式为Fe2+-e-=Fe3+
C.电池放电时,Cl-从正极室穿过选择性透过膜移向负极室
D.放电时,电路中每流过0.1 mol电子,Cr3+浓度增加0.1 mol·L-1
【答案】C
【解析】
A.电池放电时,是原电池的工作原理,正极得电子发生还原反应,电极方程式为Fe3++e-=Fe2+,A错误;
B.充电时是电解池工作原理,阴极发生得电子的还原反应,电极反应式为Cr3++e-=Cr2+,B错误;
C.电池放电时,Cl-从正极室穿过选择性透过膜移向负极室,C正确;
D.放电时,电路中每流过0.1mol电子,就会有0.1mol的三价铬离子生成,离子的浓度和体积有关,D错误;
故选C。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
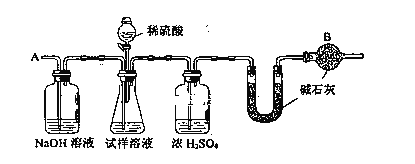
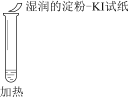
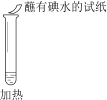
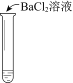
【题目】某同学向SO2和Cl2的混合气体中加入品红溶液,振荡,溶液褪色,将此无色溶液分成三份,依次进行实验,实验操作和实验现象记录如下:
序号 | |||
实验操作 |
|
|
|
实验现象 | 溶液不变红,试纸不变蓝 | 溶液不变红,试纸褪色 | 生成白色沉淀 |
下列实验分析中,不正确的是
A. ①说明Cl2被完全消耗
B. ②中试纸褪色的原因是:SO2 + I2 + 2H2O == H2SO4 + 2HI
C. ③中若将BaCl2溶液换成Ba(NO3)2溶液,也能说明SO2被Cl2氧化为SO42
D. 实验条件下,品红溶液和SO2均被氧化