ЬтФПФкШн
ЁОЬтФПЁПЬњЪЧгІгУзюЙуЗКЕФН№ЪєЃЌЬњЕФТБЛЏЮяЁЂбѕЛЏЮявдМАИпМлЬњЕФКЌбѕЫсбЮОљЮЊживЊЛЏКЯЮяЁЃ
ЃЈ1ЃЉИпЬњЫсМиЃЈK2FeO4ЃЉЪЧвЛжжЧПбѕЛЏМСЃЌПЩзїЮЊЫЎДІРэМСКЭИпШнСПЕчГиВФСЯЁЃFeCl3гыKClOдкЧПМюадЬѕМўЯТЗДгІПЩжЦШЁK2FeO4ЁЃЦфЗДгІЕФРызгЗНГЬЪНЃКFe(OH)3+ClOЃ+OHЃЁњFeO42Ѓ+H2O+ClЃЃЈЮДХфЦНЃЉЁЃХфЦНЩЯЪіРызгЗНГЬЪНЃЌгУЕЅЯпЧХЗЈБъГіЕчзгзЊвЦЗНЯђКЭЪ§ФПЁЃ___
___Fe(OH)3+___ClOЃ+___OHЃЁњ___FeO42Ѓ+___H2O+___ClЃ
ИУЗДгІжаЃЌЛЙдМСЪЧ___ЃЌБЛЛЙдЕФдЊЫиЪЧ___ЁЃ
ЃЈ2ЃЉдквЛЖЈЮТЖШЯТЃЌбѕЛЏЬњПЩвдгывЛбѕЛЏЬМЗЂЩњЗДгІЃКFe2O3(s)+3CO(g)![]() 2Fe(s)+3CO2(g)+QЁЃ
2Fe(s)+3CO2(g)+QЁЃ
вбжЊИУЗДгІдкВЛЭЌЮТЖШЯТЕФЦНКтГЃЪ§ШчБэЁЃ
ЮТЖШ/Ёц | 1000 | 1150 | 1300 |
ЦНКтГЃЪ§ | 64.0 | 50.7 | 42.9 |
ИУЗДгІЕФЦНКтГЃЪ§БэДяЪНЮЊ___ЃЌQ__0ЃЈЬюЁАЃОЁБЁЂЁАЃМЁБЛђЁА=ЁБЃЉЁЃ
ЃЈ3ЃЉдкШнЛ§ЮЊ10LЕФУмБеШнЦїжаЃЌ1000ЁцЪБМгШыFeЁЂFe2O3ЁЂCOЁЂCO2Иї1.0molЃЌЗДгІОЙ§10minКѓДяЕНЦНКтЃЌИУЪБМфЗЖЮЇФкЗДгІЕФЦНОљЗДгІЫйТЪv(CO2)=___ЃЌCOЕФЦНКтзЊЛЏТЪЮЊ____ЁЃ
ЃЈ4ЃЉгћЬсИпCOЕФЦНКтзЊЛЏТЪЃЌПЩВЩШЁЕФДыЪЉЪЧ___ЁЃ
AЃЎМѕЩйFeЕФСП BЃЎдіМгFe2O3ЕФСП
CЃЎвЦГіВПЗжCO2 DЃЎЬсИпЗДгІЮТЖШ
EЃЎМѕаЁШнЦїЕФШнЛ§ FЃЎМгШыКЯЪЪЕФДпЛЏМС
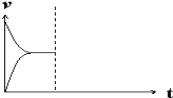
ЃЈ5ЃЉЯждкКубЙУмБеШнЦїжаЭЈШы1molH2КЭ1molCO2ЗЂЩњЗДгІЃКCO(g)+H2O(g)![]() CO2(g)+H2(g)+41kJЁЃЕБЗДгІДяЕНЦНКтКѓЃЌдкЦфЫћЬѕМўВЛБфЪБЃЌдйЭЈШы1molH2КЭ1molCO2ЕФЛьКЯЦјЬхЃЌЧыдкЭМжаЛГіе§(vе§)ЁЂФц(vФц)ЗДгІЫйТЪЫцЪБМфtБфЛЏЕФЪОвтЭМЁЃ___
CO2(g)+H2(g)+41kJЁЃЕБЗДгІДяЕНЦНКтКѓЃЌдкЦфЫћЬѕМўВЛБфЪБЃЌдйЭЈШы1molH2КЭ1molCO2ЕФЛьКЯЦјЬхЃЌЧыдкЭМжаЛГіе§(vе§)ЁЂФц(vФц)ЗДгІЫйТЪЫцЪБМфtБфЛЏЕФЪОвтЭМЁЃ___
ЁОД№АИЁП![]() FeЃЈOHЃЉ3 ТШдЊЫи
FeЃЈOHЃЉ3 ТШдЊЫи 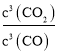 ЃМ 0.006molL-1min-10.006molL-1min-1 60% CD
ЃМ 0.006molL-1min-10.006molL-1min-1 60% CD 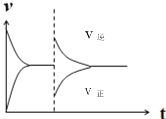
ЁОНтЮіЁП
ЃЈ1ЃЉИљОнЕчзгЪиКуКЭдЊЫиЪиКуХфЦНбѕЛЏЛЙдЗНГЬЪНЃЌЕУЕчзгЛЏКЯМлНЕЕЭзібѕЛЏМСЃЌЪЇЕчзгЛЏКЯМлЩ§ИпзіЛЙдМСЃЛ
ЃЈ2ЃЉKЮЊЩњГЩЮяХЈЖШУнжЎЛ§гыЗДгІЮяХЈЖШУнжЎЛ§ЕФБШЃЌДПЙЬЬхВЛФмДњШыKЕФБэДяЪНжаЃЛЭМБэЪ§ОнЗжЮіЃЌЫцЮТЖШЩ§ИпЦНКтГЃЪ§МѕаЁЃЛ
ЃЈ3ЃЉвРОнЛЏбЇЦНКтШ§ЖЮЪНСаЪНМЦЫуЃЌСюЦНКтЪБCOЕФЮяжЪЕФСПБфЛЏЮЊnmolЃЌРћгУШ§ЖЮЪНБэЪОГіЦНКтЪБCOЁЂCO2ЕФЮяжЪЕФСПЃЌРћгУЮяжЪЕФСПДњЬцХЈЖШДњШыЦНКтГЃЪ§МЦЫуnЕФжЕЃЌНјЖјМЦЫуCOЕФХЈЖШБфЛЏСПЃЌНјЖјЧѓзЊЛЏТЪЁЃ
ЃЈ4ЃЉЬсИпCOЕФЦНКтзЊЛЏТЪЃЌгІЪЙЦНКтЯђе§ЗДгІвЦЖЏЃЌЕЋВЛФмдіДѓCOЕФгУСПЃЌНсКЯбЁЯюИљОнЦНКтвЦЖЏдРэЗжЮіЃЛ
ЃЈ5ЃЉИУЗДгІЪЧЦјЬхЬхЛ§ВЛБфЕФЗДгІЃЌбЙЧПВЛгАЯьЦНКтЃЛЕЋЪЧКубЙЬѕМўЯТМгШыдйЭЈШы1mol H2КЭ1mol CO2ЕФЛьКЯЦјЬхКѓЃЌШнЦїЕФШнЛ§БфДѓЃЌЩњГЩЮяХЈЖШдіДѓЃЌЖјЗДгІЮяХЈЖШМѕаЁЃЌЗДгІЫйТЪЛсЗЂЩњБфЛЏЃЌОнДЫЗжЮіЁЃ
ЃЈ1ЃЉЬњдЊЫиЛЏКЯМл+3МлБфЛЏЮЊ+6МлЃЌТШдЊЫиЛЏКЯМл+1МлБфЛЏ-1МлЃЌЕчзгзЊвЦзмЪ§6e-ЃЌЗДгІЕФРызгЗНГЬЪНЮЊЃК2FeЃЈOHЃЉ3+3ClO-+4OH-=2FeO42-+3Cl-+5H2OЃЌЃЌЗДгІжаЛЙдМСFeЃЈOHЃЉ3ЃЌбѕЛЏМСЮЊClO-ЃЌБЛЛЙдЕФдЊЫиЪЧТШдЊЫиЃЌЙЪД№АИЮЊЃК![]() ЃЛFeЃЈOHЃЉ3ЃЛТШдЊЫиЃЛ
ЃЛFeЃЈOHЃЉ3ЃЛТШдЊЫиЃЛ
ЃЈ2ЃЉIЁЂ![]() жа K=
жа K=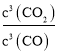 ЃЌгЩБэИёЪ§ОнПЩжЊЃЌЮТЖШдНИпЃЌKдНаЁЃЌдђЩ§ИпЮТЖШЦНКтФцЯђвЦЖЏЃЌе§ЗДгІЮЊЗХШШЗДгІЃЌЙЪQ>0ЃЌ
ЃЌгЩБэИёЪ§ОнПЩжЊЃЌЮТЖШдНИпЃЌKдНаЁЃЌдђЩ§ИпЮТЖШЦНКтФцЯђвЦЖЏЃЌе§ЗДгІЮЊЗХШШЗДгІЃЌЙЪQ>0ЃЌ
ЙЪД№АИЮЊЃК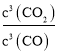 ЃЛ>ЃЛ
ЃЛ>ЃЛ
ЃЈ3ЃЉдквЛИіШнЛ§ЮЊ10LЕФУмБеШнЦїжаЃЌ1 000ЁцЪБМгШыFeЁЂFe2O3ЁЂCOЁЂCO2Иї1.0molЃЌХЈЖШЩЬQЃМK=64ЃЌЗДгІе§ЯђНјааЃЌЗДгІОЙ§10minКѓДяЕНЦНКтЃЌСюЦНКтЪБCOЕФЮяжЪЕФСПБфЛЏЮЊnmolЃЌдђЃК
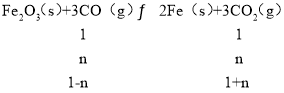
Ыљвдга ЃЌНтЕУn=0.6molЃЌЫљвдv(CO2)=
ЃЌНтЕУn=0.6molЃЌЫљвдv(CO2)=![]() ЃЌCOЕФЦНКтзЊЛЏТЪЮЊ
ЃЌCOЕФЦНКтзЊЛЏТЪЮЊ![]() ЃЌЙЪД№АИЮЊЃК0.006molL-1min-1ЃЛ60%ЃЛ
ЃЌЙЪД№АИЮЊЃК0.006molL-1min-1ЃЛ60%ЃЛ
ЃЈ4ЃЉAЃЎЬњЪЧЙЬЬхЃЌМѕЩйFeЕФСПЃЌВЛгАЯьЦНКтвЦЖЏЃЌCOЕФЦНКтзЊЛЏТЪВЛБфЃЌЙЪAДэЮѓЃЛ
BЃЎбѕЛЏЬњЪЧЙЬЬхЃЌдіМгFe2O3ЕФСПЃЌВЛгАЯьЦНКтвЦЖЏЃЌCOЕФЦНКтзЊЛЏТЪВЛБфЃЌЙЪBДэЮѓЃЛ
CЃЎвЦГіВПЗжCO2ЃЌЦНКтЯђе§ЗДгІвЦЖЏЃЌCOЕФЦНКтзЊЛЏТЪдіДѓЃЌЙЪCе§ШЗЃЛ
DЃЎИУЗДгІе§ЗДгІЪЧЗХШШЗДгІЃЌНЕЕЭЗДгІЮТЖШЃЌЦНКтЯђе§ЗДгІвЦЖЏЃЌCOЕФЦНКтзЊЛЏТЪдіДѓЃЌЙЪDе§ШЗЃЛ
EЃЎЗДгІЧАКѓЦјЬхЕФЮяжЪЕФСПВЛБфЃЌМѕаЁШнЦїЕФШнЛ§ЃЌдіДѓбЙЧПЦНКтВЛвЦЖЏЃЌCOЕФЦНКтзЊЛЏТЪВЛБфЃЌЙЪEДэЮѓЃЛ
FЃЎМгШыКЯЪЪЕФДпЛЏМСЃЌЦНКтВЛвЦЖЏЃЌЙЪFДэЮѓЃЛ
ЙЪбЁCDЁЃ
ЃЈ5ЃЉгЩгкИУЗДгІЪЧЦјЬхЬхЛ§ЯрЕШЕФЗДгІЃЌбЙЧПВЛгАЯьЦНКтЃЌЧвКубЙЃЌЫљвдзюжеЕУЕНЦНКтЪБЕФИїзщЗжКЌСПЁЂХЈЖШгыдЦНКтЭъШЋЯрЭЌЃЌЫљвдДяЕНЦНКтЪБЕФЗДгІЫйТЪгыдЦНКтЪБЕФЫйТЪЯрЕШЃЛШєдйЭЈШы1mol H2КЭ1mol CO2ЕФЛьКЯЦјЬхКѓЃЌгЩгкКубЙЬѕМўЯТЃЌШнЦїЕФШнЛ§діДѓЃЌЩњГЩЮяХЈЖШдіДѓЃЌЗДгІЮяХЈЖШМѕаЁЃЌЫљвдФцЗДгІЫйТЪдіДѓЃЌе§ЗДгІЫйТЪМѕаЁЃЌжЎКѓФцЗДгІЫйТЪж№НЅМѕаЁЃЌе§ЗДгІЫйТЪдіДѓЃЌзюжеЕУЕНгыдЦНКтЯрЕШЕФЫйТЪЃЌОнДЫЛГіЕФе§ЃЈvе§ЃЉЁЂФцЃЈvФцЃЉЗДгІЫйТЪЫцЪБМфtБфЛЏЕФЪОвтЭМЮЊЃК
 ЁЃ
ЁЃ

ЁОЬтФПЁПШэУЬПѓЕФжївЊГЩЗжЪЧMnO2ЃЌЛЙКЌгаЩйСПН№ЪєЬњЁЂУОЁЂТСЁЂаПЁЂЭЕФЛЏКЯЮяЕШдгжЪЁЃЛЦЬњПѓЕФжївЊГЩЗжЪЧFeS2ЃЌЛЙКЌгаЙшЁЂТСЕФбѕЛЏЮяЕШдгжЪЁЃЙЄвЕЩЯгУШэУЬПѓжЦБИЬМЫсУЬВЂЛиЪеСђЫсяЇЃЌЦфжївЊСїГЬШчЯТЃК
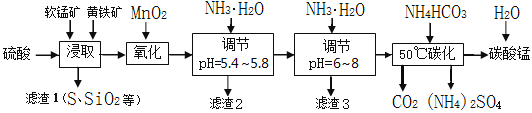
вбжЊН№ЪєРызгДгПЊЪМаЮГЩЧтбѕЛЏЮяГСЕэЃЌЕНГСЕэЪБШмвКЕФpHШчЯТБэЃК
Н№ЪєРызг | Fe2+ | Fe3+ | Al3+ | Cu2+ | Mn2+ |
ПЊЪМГСЕэpH | 7.5 | 2.7 | 4.1 | 5.9 | 8.8 |
ЭъШЋГСЕэpH | 9.5 | 3.7 | 5.4 | 6.9 | 10.8 |
ЃЈ1ЃЉЬсИпНўГіТЪЕФПЩВЩШЁЕФДыЪЉга_________ЁЃ
AЃЎЪЪЕБЩ§ИпЮТЖШ BЃЎНСАш CЃЎМгЪЪСПДПМю DЃЎМгбЙ
ЃЈ2ЃЉНўШЁЭъГЩКѓЃЌШЁНўШЁвКЩйаэЃЌМгШыKSCNШмвКЮоУїЯдЯжЯѓЃЌдђНўШЁЪБЗЂЩњЕФжївЊЗДгІЕФЛЏбЇЗНГЬЪНЪЧ____________________________________________ЁЃ
ЃЈ3ЃЉЕїНкpHЮЊ5.4ЁЋ5.8ЕФФПЕФЪЧ_____________________________________________ЁЃ
ЃЈ4ЃЉТЫдќ3ЕФжївЊГЩЗжЕФЛЏбЇЪНЪЧ_____________ЁЃ
ЃЈ5ЃЉ50ЁцЬМЛЏЙ§ГЬЗЂЩњЗДгІЕФРызгЗНГЬЪНЪЧ____________________________________ЁЃ
ЁОЬтФПЁПЪЕбщЪвжЦБИ1ЃЌ2ЃЖўфхввЭщЃЌПЩгУзуСПЕФввДМЯШжЦБИввЯЉЃЌдйгУввЯЉКЭЩйСПЕФфхжЦБИ1ЃЌ2ЃЖўфхввЭщЃЌзАжУШчЯТЭМЫљЪОЃК
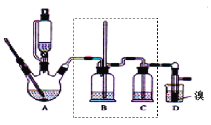
гаЙиЪ§ОнСаБэШчЯТЃК
ввДМ | 1ЃЌ2ЃЖўфхввЭщ | ввУб | |
зДЬЌ | ЮоЩЋвКЬх | ЮоЩЋвКЬх | ЮоЩЋвКЬх |
УмЖШЃЏgЁЄcmЃ3 | 0ЃЎ79 | 2ЃЎ2 | 0ЃЎ71 |
ЗаЕуЃЏЁц | 78ЃЎ5 | 132 | 34ЃЎ6 |
ШлЕуЃЏЁц | -130 | 9 | Ѓ116 |
ЛиД№ЯТСаЮЪЬтЃК
ЃЈ1ЃЉдкДЫжЦБИЪЕбщжаЃЌвЊОЁПЩФмбИЫйЕиАбЗДгІЮТЖШЬсИпЕН170ЁцзѓгвЃЌЦфзюжївЊФПЕФЪЧ____ЃЛ(Ьюе§ШЗбЁЯюЧАЕФзжФИ)
aЃЎв§ЗЂЗДгІ bЃЎМгПьЗДгІЫйЖШ cЃЎЗРжЙввДМЛгЗЂ dЃЎМѕЩйИБВњЮяввУбЩњГЩ
ЃЈ2ЃЉдкзАжУAжаГ§СЫХЈСђЫсКЭввДМЭтЃЌЛЙгІМгШы___ЃЌЦфФПЕФЪЧ_____ЃЌзАжУAжаЩњГЩИБВњЮяввУбЕФЛЏбЇЗДгІЗНГЬЪН ______ЁЃ
ЃЈ3ЃЉЪЕбщЪвжЦШЁввЯЉЃЌГЃвђЮТЖШЙ§ИпЖјЪЙввДМКЭХЈH2SO4ЗДгІЩњГЩЩйСПЕФЖўбѕЛЏСђЃЌЮЊСЫбщжЄЖўбѕЛЏСђЕФДцдкВЂГ§ШЅЖўбѕЛЏСђЖдКѓајЗДгІЕФИЩШХЃЌФГЭЌбЇдкAКЭDжЎМфМгШыСЫBЁЂCСНИізАжУЃЌЦфжаBКЭCжаПЩЗжБ№ЪЂЗХ_____
aЃЎЫсадKMnO4КЭЫЎ bЃЎЦЗКьКЭNaOHШмвК
cЃЎЫсадKMnO4КЭNaOHШмвК dЃЎЦЗКьКЭЫсадKMnO4
ЃЈ4ЃЉНЋ1ЃЌ2ЃЖўфхввЭщДжВњЦЗжУгкЗжвКТЉЖЗжаМгЫЎЃЌеёЕДКѓОВжУЃЌВњЮягІдк____Ву(ЬюЁАЩЯЁБЁЂЁАЯТЁБ)ЃЛШєВњЮяжагаЩйСПИБВњЮяввУбЁЃПЩгУ_____ЕФЗНЗЈГ§ШЅЁЃ