【题目】实验室利用呋喃甲醛为原料制备呋喃甲醇与呋喃甲酸。
Ⅰ、制备原理:
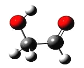
2![]() +NaOH
+NaOH![]() +
+![]()
![]() +HCl
+HCl![]() +NaCl
+NaCl
Ⅱ、实验步骤
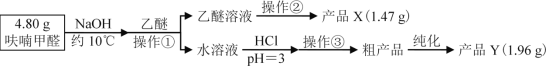
Ⅲ、相关信息
呋喃甲醛 | 呋喃甲醇 | 呋喃甲酸 | 乙醚 | |
熔点/℃ | -36.5 | -29 | 133 | -116.3 |
沸点/℃ | 161.7 | 170 | 231 | 34.5 |
水溶性 | 微溶 | 微溶 | 可溶 | 不溶 |
相对分子质量 | 96 | 98 | 112 | 74 |
Ⅳ、实验装置
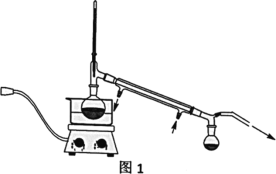
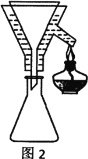
V、分析与思考,回答下列问题:
(1)操作①名称___;产品Y为___。
(2)操作②的装置如图1所示,收集产品X时温度计的读数应控制在90℃左右,其原因是___。
(3)操作①所得水溶液,加盐酸须控制pH为2~3,pH<3的理由是___;控制溶液pH时,应选择的指示剂是__。
(4)粗产品Y纯化过程用图2装置进行热过滤,具体操作:向铜漏斗中加热水→___→拆装置。涉及操作顺序最合理的选项。
A.加热漏斗支管→放入短颈漏斗→放入滤纸→放接液烧杯→倒入热的待滤液
B.放入短颈漏斗→放接液烧杯→加热漏斗支管→放入滤纸→倒入热的待滤液
C.放入短颈漏斗→放入滤纸→加热漏斗支管→放接液烧杯→倒入热的待滤液
D.放入短颈漏斗→放入滤纸→放接液烧杯→倒入热的待滤液→加热漏斗支管
(5)共消耗30mL萃取剂乙醚,从萃取效果角度思考,下列4种萃取方式最合理的是__。
A.30mL、0mL、0mL B.10mL、10mL、10mL
C.15mL、10mL、5 mL D.5mL、10mL、15mL
(6)计算产品Y的产率ω(Y)=___。
【题目】芜湖市某便利店销售的一种食用碘盐包装袋上有如下标签:
产品标准 | GB5461 |
产品等级 | 一级 |
配料 | 食盐、碘酸钾、抗结剂 |
碘含量(以I计) | 20~50mg/kg |
(1)碘酸钾与碘化钾在酸性条件下发生如下反应,请配平化学方程式:____KIO3+____KI+____H2SO4=____K2SO4+_____I2+____H2O
(2)实验室可分离获取单质碘,其实验操作可分解为如下几步:
A.把盛有溶液的分液漏斗放在铁架台的铁圈中;
B.把适量碘水和CCl4加入分液漏斗中,并盖好玻璃塞;
C.检验分液漏斗活塞和上口玻璃塞是否漏液;
D.倒转漏斗,用力振荡,并不时旋开活塞放气,最后关闭活塞,把分液漏斗放正;
E.旋开活塞,用烧杯接收下层溶液;
F.从分液漏斗的上口倒出上层水溶液;
G.将漏斗上口的玻璃塞打开;
H.静置、分层;
①正确的操作顺序是(用编号字母填写)____→____ → ___→A → __→ ___→E→F。
②下列物质,不能作为从水溶液中萃取碘的溶剂是____。
A.苯 B.汽油 C.酒精
(3)若向碘的四氯化碳溶液中加入Na2SO3稀溶液,将I2还原,以回收四氯化碳。理论上Na2SO3与I2反应的物质的量之比为____。