题目内容
【题目】我国化工专家侯德榜的“侯氏制碱法”曾为世界制碱工业做出了突出贡献。他以NaCl、NH3、CO2等为原料先制得NaHCO3,进而生产出纯碱。有关反应的化学方程式为:NH3+CO2+H2O=NH4HCO3;NH4HCO3+NaCl=NaHCO3↓+NH4Cl;2NaHCO3![]() Na2CO3+CO2↑+H2O。
Na2CO3+CO2↑+H2O。
回答下列问题:
(1)碳酸氢铵与饱和食盐水反应,能析出碳酸氢钠晶体的原因是___(填字母标号)。
a.碳酸氢钠难溶于水
b.碳酸氢钠受热易分解
c.碳酸氢钠的溶解度相对较小,所以在溶液中首先结晶析出
(2)某探究活动小组根据上述制碱原理,进行碳酸氢钠的制备实验,同学们按各自设计的方案实验。
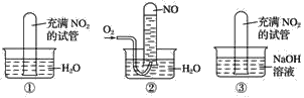
①一位同学将二氧化碳气体通入含氨的饱和食盐水中制备碳酸氢钠,实验装置如图所示(图中夹持、固定用的仪器未画出)。
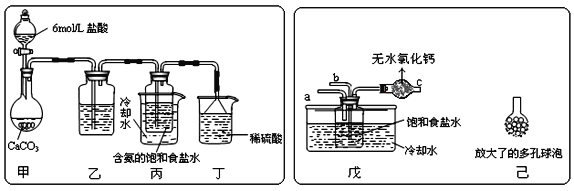
试回答下列有关问题:
(Ⅰ)乙装置中的试剂是___;
(Ⅱ)丁装置中稀硫酸的作用是___;
(Ⅲ)实验结束后,分离出NaHCO3晶体的操作是___(填分离操作的名称)。
②另一位同学用图中戊装置(其它装置未画出)进行实验。
(Ⅰ)实验时,须先从___管通入___气体,再从___管中通入___气体;
(Ⅱ)有同学建议在戊装置的b管下端连接己装置,理由是___;
(3)请你再写出一种实验室制取少量碳酸氢钠的方法:___。
【答案】c 饱和碳酸氢钠溶液 吸收逸出的NH3 过滤 a NH3 b CO2 增大气体与溶液接触面积,提高CO2吸收率 用碳酸氢铵与适量饱和食盐水反应。(或往烧碱溶液中通入过量CO2;往饱和Na2CO3溶液中通入过量CO2等)
【解析】
工业上侯氏制碱法是在饱和食盐水中通入氨气和二氧化碳,由于氨气在水中的溶解度大,所以先通入氨气,通入足量的氨气后再通入二氧化碳,生成了碳酸氢钠,由于碳酸氢钠的溶解度较小,所以溶液中有碳酸氢钠晶体析出,将碳酸氢钠晶体加热后得纯碱碳酸钠,
(1)依据题干中信息碳酸氢钠溶解度相对较小分析,所以在饱和食盐不通入氨气和二氧化碳后,碳酸氢钠晶体会析出;
(2)①(I)盐酸是易挥发性酸,在制取二氧化碳时常会含有氯化氢气体,要除去氯化氢可以用饱和碳酸氢钠溶液,盐酸与碳酸氢钠反应生成二氧化碳,且二氧化碳在碳酸氢钠溶液中溶解度很小,据此答题;
(II)实验过程中氨气可以会从溶液中逸出,稀硫酸能吸收氨气;
(III)分离固体与液体采用过滤的方法;
②(I)根据氨气易溶于水,从制取碳酸氢钠时先要得到含氨的饱和食盐水分析解答;
(II)根据图可知,装置改动后反应物的接触面积变大,提高了二氧化碳的吸收率.
(3)饱和碳酸钠溶液中通入过量二氧化碳会与碳酸氢钠析出;
(1)a.碳酸氢钠易溶于水,故错误;
b.碳酸氢钠受热易分解,与其在溶液中首先结晶析出无关,故错误;
c.碳酸氢钠的溶解度相对于氯化铵来说碳酸氢钠的溶解度更小一些,所以在溶液中首先结晶析出,故正确;故答案为:c;
(2)①(I)利用盐酸制取二氧化碳时,因盐酸易挥发,所以,二氧化碳中常会含有氯化氢气体,碳酸氢钠能与盐酸反应不与二氧化碳反应,所以通过碳酸氢钠的溶液是可以除掉二氧化碳气体中的氯化氢气体,故答案为:饱和碳酸氢钠溶液;
(II)实验过程中氨气可能会从溶液中逸出,而稀硫酸能与氨气反应,所以稀硫酸的作用是吸收末反应的NH3;
(III)分离出NaHCO3晶体的操作是分离固体与液体,常采用的实验操作是过滤操作;
②(I)制取碳酸氢钠时先要得到含氨的饱和食盐水,氨气极易溶于水,二氧化碳能溶于水,所以应先通入氨气,所以a端通入,从而保证了从b通入二氧化碳时,二氧化碳被充分反应,故答案为:a;NH3;b;CO2;
(II)装置改动后反应物的二氧化碳与溶液的接触面积增大,提高了二氧化碳的吸收率,
(3)根据侯氏制碱法的原理可知用碳酸氢铵与适量饱和食盐水反应可以析出碳酸氢钠,饱和碳酸钠溶液中通入过量二氧化碳会与碳酸氢钠析出,故答案为:用碳酸氢铵与适量饱和食盐水反应。(或往烧碱溶液中通入过量CO2;往饱和Na2CO3溶液中通入过量CO2等)

【题目】某校学习小组的同学设计实验,制备(NH4)2Fe(SO4)26H2O并探究其分解规律。实验步骤如下:
Ⅰ.称取7.0g工业废铁粉放入烧杯中,先用热的Na2CO3溶液洗涤,再水洗,最后干燥。
Ⅱ.称取6.0g上述处理后的铁粉加入25mL某浓度硫酸中加热,加热过程中不断补充蒸馏水,至反应充分。
Ⅲ.冷却、过滤并洗涤过量的铁粉,干燥后称量铁粉的质量。
Ⅳ.向步骤Ⅲ的滤液中加入适量(NH4)2SO4晶体,搅拌至晶体完全溶解,经一系列操作得干燥纯净的(NH4)2Fe(SO4)26H2O。
V.将(NH4)2Fe(SO4)26H2O脱水得(NH4)2Fe(SO4)2,并进行热分解实验。
已知在不同温度下FeSO47H2O的溶解度如表:
温度(℃) | 1 | 10 | 30 | 50 |
溶解度(g) | 14.0 | 17.0 | 25.0 | 33.0 |
回答下列问题:
(1)步骤Ⅰ用热的Na2CO3溶液洗涤工业废铁粉的目的是__,步骤Ⅱ中设计铁粉过量,是为了__,加热反应过程中需不断补充蒸馏水的目的是__。
(2)步骤Ⅲ中称量反应后剩余铁粉的质量,是为了__。
(3)(NH4)2Fe(SO4)2分解的气态产物可能有N2、NH3、SO2、SO3及水蒸气,用下列装置检验部分产物。

①检验气态产物中的SO2和SO3时,装置连接顺序依次为__(气流从左至右);C中盛放的试剂为__。
②装置A的作用是__。
③检验充分分解并冷却后的瓷舟中铁的氧化物中是否含有二价铁,需用到的试剂为__。