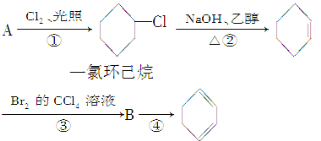
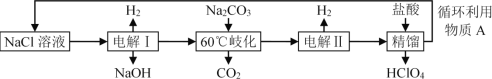
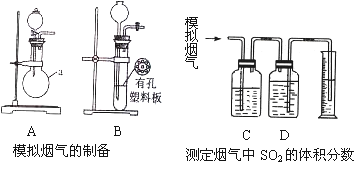
题目内容
【题目】偏二甲肼与N2O4是常用的火箭推进剂,二者发生如下化学反应:(CH3)2NNH2(l)+2N2O4(l)=2CO2(g)+3N2(g)+4H2O(g)(Ⅰ)![]()
(1)反应(Ⅰ)中氧化剂是___。
(2)火箭残骸中常现红棕色气体,原因为:N2O4(g)![]() 2NO2(g) ΔH(Ⅱ)
2NO2(g) ΔH(Ⅱ)
当温度升高时,气体颜色变深,则反应(Ⅱ)中ΔH___0(填“>”或“<”),保持温度和体积不变向上述平衡体系中再充入一定量的N2O4,混合气体的颜色__(填“变深”或“变浅”)。
【答案】N2O4 > 变深
【解析】
(1)根据化合价的变化分析,化合价降低的做氧化剂被还原;
(2)当温度升高时,气体颜色变深,说明平衡正向进行,正反应为吸热反应,ΔH >0;保持温度和体积不变向上述平衡体系中再充入一定量的N2O4,相当于成比例增大反应物,据此回答。
(1)反应(Ⅰ)中,N2O4(l)中N元素化合价从+4得到电子变成0价,得电子发生还原反应,N2O4(l)是氧化剂;
答案为N2O4。
(2)N2O4(g)2NO2(g) (Ⅱ),当温度升高时,气体颜色变深,说明平衡正向移动,正反应为吸热反应,则ΔH >0;保持温度和体积不变向上述平衡体系中再充入一定量的N2O4,相当于成比例增大反应物,即增大压强平衡向气体体积减小的方向移动即逆反应方向,虽然NO2的体积分数减小,但二氧化氮的浓度仍然增大,则混合气体的颜色变深;
答案为>;变深。

 应用题作业本系列答案
应用题作业本系列答案 暑假作业暑假快乐练西安出版社系列答案
暑假作业暑假快乐练西安出版社系列答案【题目】实验室利用呋喃甲醛为原料制备呋喃甲醇与呋喃甲酸。
Ⅰ、制备原理:
2![]() +NaOH
+NaOH![]() +
+![]()
![]() +HCl
+HCl![]() +NaCl
+NaCl
Ⅱ、实验步骤
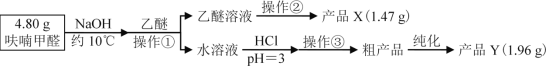
Ⅲ、相关信息
呋喃甲醛 | 呋喃甲醇 | 呋喃甲酸 | 乙醚 | |
熔点/℃ | -36.5 | -29 | 133 | -116.3 |
沸点/℃ | 161.7 | 170 | 231 | 34.5 |
水溶性 | 微溶 | 微溶 | 可溶 | 不溶 |
相对分子质量 | 96 | 98 | 112 | 74 |
Ⅳ、实验装置
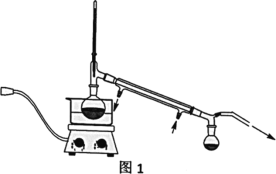
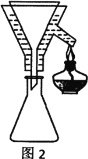
V、分析与思考,回答下列问题:
(1)操作①名称___;产品Y为___。
(2)操作②的装置如图1所示,收集产品X时温度计的读数应控制在90℃左右,其原因是___。
(3)操作①所得水溶液,加盐酸须控制pH为2~3,pH<3的理由是___;控制溶液pH时,应选择的指示剂是__。
(4)粗产品Y纯化过程用图2装置进行热过滤,具体操作:向铜漏斗中加热水→___→拆装置。涉及操作顺序最合理的选项。
A.加热漏斗支管→放入短颈漏斗→放入滤纸→放接液烧杯→倒入热的待滤液
B.放入短颈漏斗→放接液烧杯→加热漏斗支管→放入滤纸→倒入热的待滤液
C.放入短颈漏斗→放入滤纸→加热漏斗支管→放接液烧杯→倒入热的待滤液
D.放入短颈漏斗→放入滤纸→放接液烧杯→倒入热的待滤液→加热漏斗支管
(5)共消耗30mL萃取剂乙醚,从萃取效果角度思考,下列4种萃取方式最合理的是__。
A.30mL、0mL、0mL B.10mL、10mL、10mL
C.15mL、10mL、5 mL D.5mL、10mL、15mL
(6)计算产品Y的产率ω(Y)=___。