��Ŀ����
����Ŀ����1������ȼ�ϵ����һ�ָ�Ч����Ⱦ����������ּ��ԣ���KOH������ʣ������ԣ�������������ʣ�ȼ�ϵ�ء����������ȼ�ϵ�أ���������Ӧ����ʽ��___��
��2��������Ա��������ͼԭ���װ���������ᣬ���ĵ缫��ӦʽΪ___��
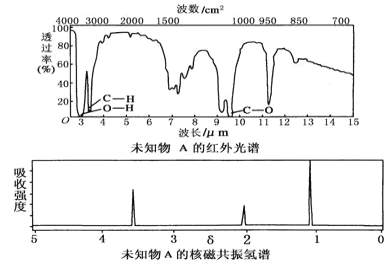
��3�����Ȼ�����(S2Cl2)��һ������ɫҺ�壬�Ǻϳ���Ⱦ�ϵ���Ҫԭ�ϡ�
a.S2Cl2����������ԭ�Ӷ�����8�����ȶ��ṹ��д�����ĵ���ʽ__��
b.ָ���������ڵļ���__��
��4������ʽΪC5H12O���л����������Ʒ�Ӧ������������__�֣������ܹ���������������ȩ����___�֡�
��5�������л��б�ϩ���ʣ�д�����ӵĻ�ѧ��Ӧ����ʽ__��
���𰸡�O2+4e-+4H+=2H2O SO2-2e-+2H2O=SO![]() +4H+
+4H+ ![]() ���Լ��ͷǼ��Լ� 8 4 CH3��CH=CH2+Br2��CH3��CHBr��CH2Br
���Լ��ͷǼ��Լ� 8 4 CH3��CH=CH2+Br2��CH3��CHBr��CH2Br
��������
����ԭ���ԭ����������ԭ��Ӧԭ����д�缫��Ӧʽ�����ݼۼ�������д����ʽ�����ݹ���������ȷ���л������࣬ͨ��̼���칹��λ���칹ȷ��ͬ���칹��������
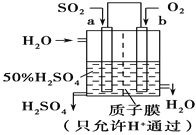
��1����������ȼ�ϵ�أ���������������ԭ��Ӧ����������Ӧ����ʽ��O2+4e-+4H+=2H2O��
��2������ͼ����������������Ӧ�������ᣬa��Ϊ����������������ԭ��Ӧ����ˮ��b��Ϊ���������ĵ缫��ӦʽΪSO2-2e-+2H2O=SO![]() +4H+��
+4H+��
��3��a.Sԭ���������6�����ӣ��õ�2�����ӻ��γ����Թ��õ��ӶԴﵽ8���ӽṹ��Clԭ���������7�����ӣ��õ�1�����ӻ��γ�1�Թ��õ��ӶԴﵽ8���ӽṹ��S2Cl2����������ԭ�Ӷ�����8�����ȶ��ṹ�����ĵ���ʽ![]() ��
��
b.���ݵ���ʽ��֪���������ڵļ���Ϊ���Լ���S��Cl�����ͷǼ��Լ���S��S������
��4������ʽΪC5H12O���л����������Ʒ�Ӧ��������������Ϊ��������̼���칹��λ���칹��ͬ���칹����8�֣������ܹ���������������ȩ��˵���ṹ�к��С�CH2OH������д��C4H9CH2OH��C4H9����4�֣����ܹ���������������ȩ��ͬ���칹����4�֡�
��5�������л��б�ϩ���ʣ������ṹ �Ƚ��ȶ���ϩ�������ӳɷ�Ӧ���ʳ��ӱ�ϩ��������ˮ����ѧ��Ӧ����ʽCH3��CH=CH2+Br2��CH3��CHBr��CH2Br��

 ��У����ϵ�д�
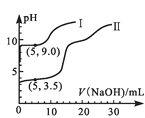
��У����ϵ�д�����Ŀ����һ��������ܱ������У��������»�ѧ��Ӧ��CO2��g��+H2��g��![]() CO��g��+H2O��g�����仯ѧƽ�ⳣ��K���¶�t�Ĺ�ϵ���±���
CO��g��+H2O��g�����仯ѧƽ�ⳣ��K���¶�t�Ĺ�ϵ���±���
t�� | 700 | 800 | 830 | 1000 | 1200 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
�ش��������⣺
��1���÷�ӦΪ___��Ӧ��ѡ�����ȡ����ȣ���
��2��ij�¶��£�ƽ��Ũ�ȷ�����ʽ��c��CO2����c��H2��=c��CO����c��H2O�������жϴ�ʱ���¶�Ϊ___�档
����Ŀ����.�ⶨ��ѧ��Ӧ����
ijͬѧ������ͼװ�òⶨ��ѧ��Ӧ���ʡ�
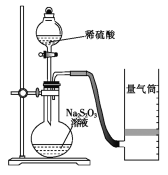
(��֪��S2O32-+2H+=H2O+S��+SO2��)
��1��Ϊ��֤ʵ��ȷ�ԡ��ɿ��ԣ����ø�װ�ý���ʵ��ǰӦ�Ƚ��еIJ�����__������ͼ��ʾ��ʵ����Ʒ�������⣬����Ҫ��һ��ʵ��������__��
��2������2minʱ�ռ���224mL(������ɱ�״��)���壬�ɼ������2min��H+�ķ�Ӧ���ʣ����òⶨֵ��ʵ��ֵƫС����ԭ����___��
��.Ϊ̽�ֻ�ѧ��Ӧ���ʵ�Ӱ������
ijС������H2C2O4��Һ������KMnO4��Һ��Ӧ��̽������������Ի�ѧ��Ӧ���ʵ�Ӱ�족����֪��5H2C2O4+2KMnO4+3H2SO4=K2SO4+2MnSO4+10CO2��+8H2O
ʵ��ʱ��ͨ���ⶨ��ɫ����ʱ�����жϷ�Ӧ�Ŀ�������ѡ�Լ���������0.20mol/LH2C2O4��Һ��0.010mol/L����KMnO4��Һ������ˮ����ƿ������ˮԡ�ۣ���Ͳ���������С����������µķ�����
������ | ˮ | H2C2O4��Һ | ����KMnO4��Һ | �¶�/�� | ||
���/mL | Ũ��/molL-1 | ���/mL | Ũ��/molL-1 | ���/mL | ||
�� | 0 | 0.20 | 2.0 | 0.010 | 4.0 | 50 |
�� | 0 | 0.20 | 2.0 | 0.010 | 4.0 | 25 |
�� | 1.0 | 0.010 | 4.0 | 25 | ||
��1����֪��Ӧ��H2C2O4ת��ΪCO2�ݳ���KMnO4ת��ΪMnSO4��Ϊ�˹۲쵽��ɫ��ȥ��H2C2O4��KMnO4��ʼ�����ʵ�����Ҫ����Ĺ�ϵΪ��n(H2C2O4)��n(KMnO4)��__��
��2��ʵ��۲��KMnO4��Һ����ɫʱ��Ϊ40s�����Ի��ǰ����Һ�����С�仯�����ʱ����ƽ����Ӧ����v��KMnO4��=__mol��L-1��min-1��
��3������ɱ����ڶ����հ�__��__��
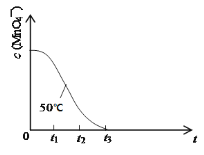
��4����֪50��ʱc(MnO4-)����Ӧʱ��t�ı仯������ͼ�����з�Ӧ�������Ľ���__��ԭ����___��
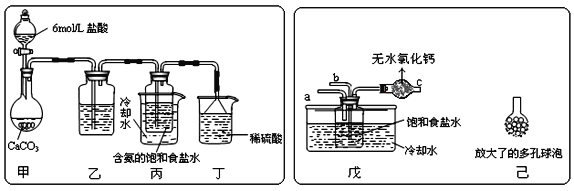
����Ŀ��ij��ѧ��ȤС���ͬѧ������ͼ��ʾʵ��װ�ý���ʵ��(ͼ��a��b��c��ʾֹˮ��) ��

(1)A��C��E�������װ�ÿ�������ȡCl2��������ص�����ʵ�顣�����ڱ��м�������ˮ�������Ƶ���ˮ����������ˮ����ʵ�飬ʵ����������������£�
ʵ����� | �� �� | �� �� |
��ˮ�м���̼�����Ʒ�ĩ | ����ɫ���ݲ��� | ������ˮ��Ӧ�IJ���������� |
ʵ��Ľ����Ƿ����__________����ѡ�������������˵������______________________������������װ�����һ����ʵ����֤Cl-��S2-�Ļ�ԭ��ǿ��,��ס��ҡ�����ʢ�ŵ��Լ��Ǽ�__________________ ��__________________ ��__________________
(2)B��D��Eװ����������B��ʢװŨ�����ͭƬ(�����п����ϰ���)�����Ƶò�����NO2�й�ʵ�顣����Dװ����֤NO2��ˮ�ķ�Ӧ�����������Ϊ���ȹر�ֹˮ��________���ٴ�ֹˮ��________��ʹ�ձ��е�ˮ�����Թܶ��IJ����ǣ�___________________________________ʹ�Թ��е������ݳ���NO2��ˮ�Ӵ��������ձ��е�ˮ�����Թܶ���