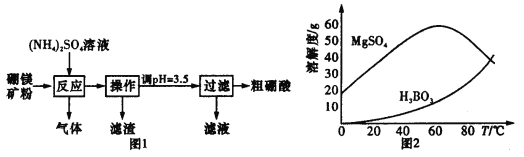
题目内容
【题目】储氢材料甲由X、Y、Z三种短周期元素组成,Z元素的最外层电子数是X与Y元素最外层电子数之和的1.5倍。为确定甲的组成,进行了如下实验:
①称取5.4g甲固体,加热到250℃时,完全反应后,放出标准状况下3.36 L单质气体乙,同时得到两种固体,其中一种为二元化合物。
②冷却后,向①反应后的固体混合物中加入足量的蒸馏水,充分反应后,又放出标准状况下5.6L单质气体乙,同时得到澄清溶液丙。
请回答:
(1)乙的电子式___。
(2)甲的化学式__。
(3)写出生成溶液丙的化学反应方程式___。
(4)设计实验方案检验溶液丙中的溶质成分___。
【答案】H∶H NaAlH4 2NaH+2Al+4H2O=2NaAlO2+5H2↑ 用洁净的铂丝蘸取丙溶液进行焰色反应,显黄色,证明含Na+;另取少量丙溶液于试管中,逐滴滴加稀盐酸,若出现白色沉淀,继而沉淀消失,则含有AlO2-
【解析】
常见的储氢材料是金属氢化物,加热到250℃时,完全反应后,放出标准状况下3.36 L单质气体乙,气体乙是氢气,所以一定含有H元素;短周期元素中化合价最高的金属元素是+3价Al元素,Z元素的最外层电子数是X与Y元素最外层电子数之和的1.5倍,故Z是
Al元素,则另一种金属元素化合价为+1,反应②得到澄清溶液丙,说明另一种金属元素一定为钠。
(1)常见的储氢材料是金属氢化物,加热到250℃时,完全反应后,放出标准状况下3.36 L单质气体乙,所以一定含有H元素,气体乙是氢气,电子式为H∶H。
(2)①②共生成标准状况下的氢气8.96L÷22.4L/mol=0.4mol,根据得失电子守恒,5.4g甲固体含有0.4molH原子;设5.4g甲固体含有Al元素xmol、Na元素ymol,则![]() ,解得y=0.1、x=0.1, n(Na):n(Al):n(H)=0.1:0.1:0.4=1:1:4,甲的化学式是NaAlH4;
,解得y=0.1、x=0.1, n(Na):n(Al):n(H)=0.1:0.1:0.4=1:1:4,甲的化学式是NaAlH4;
(3)钠的活泼性大于铝,反应①生成的固体是NaH和Al,NaH与水反应生成氢氧化钠和氢气,氢氧化钠与铝反应生成偏铝酸钠和氢气,总反应方程式是2NaH+2Al+4H2O=2NaAlO2+5H2↑。
(4)AlO2-与少量盐酸反应先生成氢氧化铝沉淀,氢氧化铝与盐酸反应生成铝离子,Na+的焰色反应呈黄色;检验溶液丙中的溶质成分的方法是:用洁净的铂丝蘸取丙溶液进行焰色反应,显黄色,证明含Na+;另取少量丙溶液于试管中,逐滴滴加稀盐酸,若出现白色沉淀,继而沉淀消失,则含有AlO2-。