【题目】2018年3月南京理工教授制出了一种新的全氮阴离子盐—AgN5,目前已经合成出钠、锰、铁、钴、镍、镁等几种金属的全氮阴离子盐。
(1)基态Mn2+的价电子排布式为____;银与铜位于同一族,银元素位于元素周期表的___区。
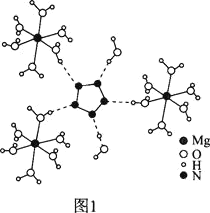
(2)[Mg(H2O)6]2+[(N5)2(H2O)4]2-的晶体的部分结构如图1所示:
N、O、Mg元素的前3级电离能如下表所示:
元素 | I1/kJmol-1 | I2/kJmol-1 | I3/kJmol-1 |
X | 737.7 | 1450.7 | 7732.7 |
Y | 1313.9 | 3388.3 | 5300.5 |
Z | 1402.3 | 2856.0 | 4578.1 |
①X、Y、Z中为N元素的是____,判断理由是__________。
②从作用力类型看,Mg2+与H2O之间是________、N5与H2O之间是________。
③N5-为平面正五边形,N原子的杂化类型是_______。科学家预测将来还会制出含N4-、N6-等平面环状结构离子的盐,这一类离子中都存在大π键,可用符号![]() 表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为
表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为![]() ),则N4-中的大π键应表示为_________。
),则N4-中的大π键应表示为_________。
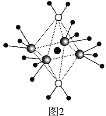
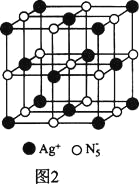
(3)AgN5的立方晶胞结构如图2所示,Ag+周围距离最近的Ag+有_______个。若晶体中紧邻的N5-与Ag+的平均距离为a nm,NA表示阿伏加德罗常数的值,则AgN5的密度可表示为_____gcm-3(用含a、NA的代数式表示)。
【题目】已知X、Y、Z、W为原子序数依次增大的四种短周期主族元素,前三种元素原子的电子层数相同,Y、W元素原子的最外层电子数相同。表给出了四种元素的部分信息,则下列说法正确的是
元素 | X | Y | Z | W |
原子半径/nm | 0.134 | r1 | r2 | 0.106 |
A.r1>r2>0.106
B.0.134<r1<r2
C.0.134>r1>r2
D.电子层数多的元素的原子半径一定比较大
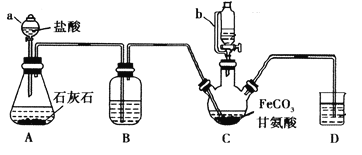
【题目】甘氨酸亚铁[(NH2CH2COO)2Fe]是一种补铁强化剂。某学习小组利用FeCO3与甘氨酸(NH2CH2COOH)制备甘氨酸亚铁,实验装置如下图所示(夹持和加热仪器已省略)。
有关物质性质如下表:
甘氨酸 | 柠檬酸 | 甘氨酸亚铁 |
易溶于水,微溶于乙醇 | 易溶于水和乙醇 | 易溶于水,难溶于乙醇 |
两性化合物 | 强酸性、强还原性 |
实验过程:
I.合成:装置C中盛有0.1mol FeCO3和200mL1.0mol·L-1甘氨酸溶液和适量柠檬酸。实验时,先打开仪器a的活塞,待装置c中空气排净后,加热并不断搅拌,并通过仪器b向C中加入适量氢氧化钠溶液调节pH到6左右,使反应物充分反应。
Ⅱ.分离:反应结束后,过滤,将滤液进行蒸发浓缩;加入无水乙醇,过滤、洗涤并干燥。
回答下列问题:
(1)仪器a的名称是________;与a相比,仪器b的优点是_____________________________。
(2)装置B中盛有的试剂是____________;实验过程中装置D的导管一直没入液面下的必要性是___________________________________________。
(3)合成过程加入柠檬酸的作用是促进FeCO3溶解和________________________ 。
(4)加入氢氧化钠溶液调节pH若大于6,甘氨酸亚铁产量下降。原因可用离子方程式表示为________。
(5)过程II中加入无水乙醇的目的是_______________________。
(6)检验产品中是否含有Fe3+的试剂名称是_________ 。
(7)本实验制得15.3g甘氨酸亚铁(M=204g/mol),则其产率是_____%。
【题目】机动车排放的污染物主要有碳氢化合物、一氧化碳和氮氧化物等。
I.汽油燃油车上安装三元催化转化器,可有效降低汽车尾气污染。
(1)已知: C(s)+O2(g) =CO2(g) △H1 = 393.5kJ·mol1
2C(s)+O2(g) =2CO(g) △H2 = 221.0 kJ·mol1
N2(g)+O2(g) =2NO(g) △H 3 =+180.5 kJ·mol1
CO和NO两种尾气在催化剂作用下生成N2的热化学方程式是_________________________。
(2)研究CO和NO的催化反应,用气体传感器测得在某温度下、一定体积的密闭容器中,不同时间NO和CO浓度如下表:
时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
c(NO)/(104mol·L1) | 10.0 | 4.50 | 2.50 | 1.50 | 1.00 | 1.00 |
c(CO)/(103mol·L1) | 3.60 | 3.05 | 2.85 | 2.75 | 2.70 | 2.70 |
① 前4 s内的平均反应速率υ(CO) =______mol·L1·s1。
② L、X可分别代表压强或温度。下图A表示L一定时,NO(g)的平衡转化率随X的变化关系。X代表的物理量是______。判断L1、L2的大小关系______,并简述理由:______________________________。

(3)实验测得,v正=k正·c2(NO)·c2(CO),v逆=k逆·c(N2) ·c2(CO2)(k正、k逆为速率常数,只与温度有关)。
①达到平衡后,仅升高温度,k正增大的倍数______(填“>”、“<”或“=”)k逆增大的倍数。
②若在2 L的密闭容器中充入1 mol CO和1 mol NO,在一定温度下达到平衡时,CO的转化率为40%,则k正︰k逆 =__________。(保留一位小数)
II. 有人利用反应C(s)+2NO(g) ![]() N2(g)+CO2(g) ΔH = 34.0 kJ·mol1,用活性炭对NO进行吸附。现在密闭容器中加入足量的C和一定量的NO气体并在催化剂作用下发生反应,经相同时间测得NO的转化率随温度的变化如图B所示。由图可知最高转化率对应温度为450℃。低于450℃时,NO的转化率______(填“是”或者“不是”)对应温度下的平衡转化率,判断理由是________________________;高于450OC时,NO的转化率降低的可能原因是___________(填标号)
N2(g)+CO2(g) ΔH = 34.0 kJ·mol1,用活性炭对NO进行吸附。现在密闭容器中加入足量的C和一定量的NO气体并在催化剂作用下发生反应,经相同时间测得NO的转化率随温度的变化如图B所示。由图可知最高转化率对应温度为450℃。低于450℃时,NO的转化率______(填“是”或者“不是”)对应温度下的平衡转化率,判断理由是________________________;高于450OC时,NO的转化率降低的可能原因是___________(填标号)
A.催化剂活性降低 B.平衡常数变小 C. 反应活化能增大
【题目】现使用酸碱中和滴定法测定市售白醋的总酸量(g·100 mL-1)。
Ⅰ.实验步骤
(1)配制待测白醋溶液,用____(填仪器名称)量取10.00 mL食用白醋,在____(填仪器名称)中用水稀释后转移到100 mL____(填仪器名称)中定容,摇匀即得待测白醋溶液。
(2)量取待测白醋溶液20.00 mL于锥形瓶中,向其中滴加2滴____作指示剂。
(3)读取盛装0.1000 mol/L NaOH溶液的碱式滴定管的初始读数。
(4)滴定。判断滴定终点的现象是____,达到滴定终点,停止滴定,并记录NaOH溶液的最终读数,重复滴定3~4次。
(5)如图是某次滴定时的滴定管中的液面,其读数为____mL。
![]()
Ⅱ.实验记录
滴定次数 实验数据(mL) | 1 | 2 | 3 | 4 |
V(样品) | 20.00 | 20.00 | 20.00 | 20.00 |
V(NaOH)(消耗) | 15.95 | 15.00 | 15.05 | 14.95 |
Ⅲ.数据处理与讨论
(6)按正确数据处理,得出c(市售白醋)=____mol/L,市售白醋总酸量=____g·100 mL-1。
【题目】一定温度下,在三个体积均为2.0 L的恒容密闭容器中发生反应:PCl5(g)![]() PCl3(g)+Cl2(g)。
PCl3(g)+Cl2(g)。
编号 | 温度 /℃ | 起始物质 的量/mol | 平衡物质 的量/mol | 达到平衡 所需时间/s | |
PCl5(g) | PCl3(g) | Cl2(g) | |||
Ⅰ | 320 | 0.40 | 0.10 | 0.10 | t |
Ⅱ | 320 | 0.80 | t1 | ||
Ⅲ | 410 | 0.40 | 0.15 | 0.15 | t2 |
下列说法正确的是
A.平衡常数K:容器Ⅱ>容器Ⅲ
B.反应到达平衡时,PCl5的转化率:容器Ⅱ>容器Ⅰ
C.反应到达平衡时,容器Ⅰ中的平均速率为v(PCl5)=![]() mol·L-1·s-1
mol·L-1·s-1
D.起始时向容器Ⅲ中充入PCl5 0.30 mol、PCl3 0.45 mol和Cl2 0.10 mol,则反应将向逆反应方向进行