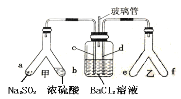
题目内容
【题目】现使用酸碱中和滴定法测定市售白醋的总酸量(g·100 mL-1)。
Ⅰ.实验步骤
(1)配制待测白醋溶液,用____(填仪器名称)量取10.00 mL食用白醋,在____(填仪器名称)中用水稀释后转移到100 mL____(填仪器名称)中定容,摇匀即得待测白醋溶液。
(2)量取待测白醋溶液20.00 mL于锥形瓶中,向其中滴加2滴____作指示剂。
(3)读取盛装0.1000 mol/L NaOH溶液的碱式滴定管的初始读数。
(4)滴定。判断滴定终点的现象是____,达到滴定终点,停止滴定,并记录NaOH溶液的最终读数,重复滴定3~4次。
(5)如图是某次滴定时的滴定管中的液面,其读数为____mL。
![]()
Ⅱ.实验记录
滴定次数 实验数据(mL) | 1 | 2 | 3 | 4 |
V(样品) | 20.00 | 20.00 | 20.00 | 20.00 |
V(NaOH)(消耗) | 15.95 | 15.00 | 15.05 | 14.95 |
Ⅲ.数据处理与讨论
(6)按正确数据处理,得出c(市售白醋)=____mol/L,市售白醋总酸量=____g·100 mL-1。
【答案】酸式滴定管 烧杯 容量瓶 酚酞 溶液由无色变为浅红色,且半分钟内不褪色 22.60 0.75 4.5
【解析】
(1)准确量取一定体积的液体要使用滴定管,根据溶液酸碱性判断使用的滴定管的类型,根据配制物质的量浓度的溶液操作分析判断使用的仪器;
(2)根据酸、碱恰好中和时产生盐的酸碱性判断使用哪种指示剂;
(4)根据酚酞的变色范围为8.2~10.0,结合溶液的酸碱性判断滴定终点溶液的颜色变化;
(5)根据滴定管的结构:滴定管小刻度在上,大刻度在下,结合其精确度判断溶液的体积读数;
(6)去掉不合理实验数据,计算平均消耗的NaOH溶液的体积,根据二者恰好中和时n(CH3COOH)=n(NaOH),利用c=![]() 计算醋酸的浓度及市售白醋总酸量。
计算醋酸的浓度及市售白醋总酸量。
(1)白醋溶液显酸性,准确量取10.00 mL食用白醋要使用酸式滴定管;将量取的白醋在烧杯中进行稀释,然后将稀释后的溶液转移至100 mL的容量瓶中进行定容、摇匀,即得待测白醋溶液;
(2)NaOH与醋酸恰好中和产生CH3COONa是强碱弱酸盐,水解使溶液显碱性,所以要使用碱性范围内变色的酚酞为指示剂,可以减小滴定误差,故使用的指示剂为酚酞;
(4)白醋溶液显酸性,使酚酞试液显无色,随着NaOH的滴入,溶液酸性逐渐减弱,碱性逐渐增强,当滴加最后一滴NaOH溶液时,溶液由无色变为浅红色,且半分钟内不褪色,说明滴定达到终点,此时应停止滴加NaOH溶液;
(5)由滴定管凹液面所在位置,结合滴定管精确度为0.01 mL,可知该溶液的液面读数为22.60 mL;
(6)根据表格中四次实验结果数值可知:第一次实验数据偏差较大,要舍去,20.00 mL稀释的醋酸溶液反应消耗NaOH溶液的平均体积为V(NaOH)=![]() mL=15.00 mL,根据CH3COOH+NaOH=CH3COONa+H2O可知n(CH3COOH)=n(NaOH),所以稀释后的醋酸溶液的浓度c(CH3COOH)=
mL=15.00 mL,根据CH3COOH+NaOH=CH3COONa+H2O可知n(CH3COOH)=n(NaOH),所以稀释后的醋酸溶液的浓度c(CH3COOH)=![]() =0.075 mol/L,由实验操作可知:是将10.00 mL白醋稀释至100 mL,由于在稀释过程中溶质的物质的量不变,溶液的体积是原食醋的10倍,则稀释后溶液浓度为原食醋浓度的
=0.075 mol/L,由实验操作可知:是将10.00 mL白醋稀释至100 mL,由于在稀释过程中溶质的物质的量不变,溶液的体积是原食醋的10倍,则稀释后溶液浓度为原食醋浓度的![]() ,故该市售食醋的物质的量浓度c(市售白醋)=10×0.075 mol/L =0.75 mol/L。在100 mL该食醋中含有醋酸的物质的量为n(CH3COOH)=c·V=0.75 mol/L×0.1 L=0.075 mol,其质量为m(CH3COOH)=0.075 mol×60 g/mol=4.5 g,即市售白醋总酸量=4.5 g·100 mL-1。
,故该市售食醋的物质的量浓度c(市售白醋)=10×0.075 mol/L =0.75 mol/L。在100 mL该食醋中含有醋酸的物质的量为n(CH3COOH)=c·V=0.75 mol/L×0.1 L=0.075 mol,其质量为m(CH3COOH)=0.075 mol×60 g/mol=4.5 g,即市售白醋总酸量=4.5 g·100 mL-1。

【题目】甲醇是重要的有机化工原料,目前世界甲醇年产量超过2.1×107吨,在能源紧张的今天,甲醇的需求也在增大。甲醇的合成方法是:
(ⅰ)CO(g)+2H2(g)=CH3OH(g) ΔH=-90.1kJ·mol-1
另外:(ⅱ)2CO(g)+O2(g)=2CO2(g) ΔH=-566.0kJ·mol-1
(ⅲ)2H2(g)+O2(g)=2H2O(l) ΔH=-572.0kJ·mol-1
回答下列问题:
(1)甲醇的燃烧热为__kJ·mol-1。
(2)在碱性条件下利用一氯甲烷(CH3Cl)水解也可制备少量的甲醇,该反应的化学方程式为__。
(3)若反应在密闭恒容绝热容器中进行,反应(iv)CO2(g)+H2(g)=CO(g)+H2O(g) ΔH=+41.1kJ·mol-1对合成甲醇反应中CO的转化率的影响是(_________)
a.增大 b.减小 c.无影响 d.无法判断
(4)在恒温恒容的密闭容器中发生反应(ⅰ),各物质的浓度如下表:
浓度/mol·L-1 时间/min | c(CO) | c(H2) | c(CH3OH) |
0 | 0.8 | 1.6 | 0 |
2 | 0.6 | x | 0.2 |
4 | 0.3 | 0.6 | 0.5 |
6 | 0.3 | 0.6 | 0.5 |
①x=__。
②前2min内H2的平均反应速率为v(H2)=__。该温度下,反应(ⅰ)的平衡常数K=__。(保留1位小数)
③反应进行到第2min时,改变了反应条件,改变的这个条件可能是(_________)
a.使用催化剂 b.降低温度 c.增加H2的浓度
(5)如图是温度、压强与反应(ⅰ)中CO转化率的关系:
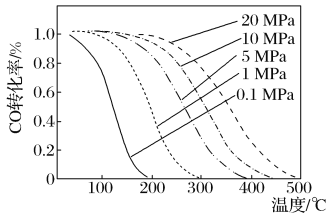
由图像可知,温度越低,压强越大,CO转化率越高,但实际生产往往采用300~400℃和10MPa的条件,其原因是__。