题目内容
【题目】2018年3月南京理工教授制出了一种新的全氮阴离子盐—AgN5,目前已经合成出钠、锰、铁、钴、镍、镁等几种金属的全氮阴离子盐。
(1)基态Mn2+的价电子排布式为____;银与铜位于同一族,银元素位于元素周期表的___区。
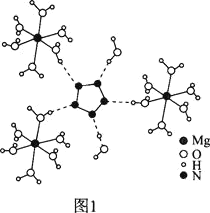
(2)[Mg(H2O)6]2+[(N5)2(H2O)4]2-的晶体的部分结构如图1所示:
N、O、Mg元素的前3级电离能如下表所示:
元素 | I1/kJmol-1 | I2/kJmol-1 | I3/kJmol-1 |
X | 737.7 | 1450.7 | 7732.7 |
Y | 1313.9 | 3388.3 | 5300.5 |
Z | 1402.3 | 2856.0 | 4578.1 |
①X、Y、Z中为N元素的是____,判断理由是__________。
②从作用力类型看,Mg2+与H2O之间是________、N5与H2O之间是________。
③N5-为平面正五边形,N原子的杂化类型是_______。科学家预测将来还会制出含N4-、N6-等平面环状结构离子的盐,这一类离子中都存在大π键,可用符号![]() 表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为
表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为![]() ),则N4-中的大π键应表示为_________。
),则N4-中的大π键应表示为_________。
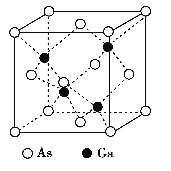
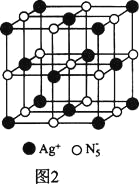
(3)AgN5的立方晶胞结构如图2所示,Ag+周围距离最近的Ag+有_______个。若晶体中紧邻的N5-与Ag+的平均距离为a nm,NA表示阿伏加德罗常数的值,则AgN5的密度可表示为_____gcm-3(用含a、NA的代数式表示)。
【答案】3d5 ds Z X最外层为2个电子,X为镁;N的2p轨道处于半充满的稳定状态,其失去第一个电子较难,I1较大,则Z为氮元素 配位键 氢键 sp2 ![]() 12
12 ![]()
【解析】
(1)根据构造原理书写出25号Mn元素的原子核外电子排布式,Mn原子失去最外层2个电子得到Mn2+;根据原子结构与元素在周期表的位置确定Ag在周期表所属区域;
(2)①根据元素的电离能大小结合原子结构确定X、Y、Z三种元素,然后判断哪种元素是N元素;
②根据图示,判断晶体中阳离子、阴离子中含有的作用力类型;
③结合N5-为平面正五边形结构,结合原子杂化类型与微粒构型关系分析判断,结合微粒的原子结构分析大π键的形成;
(3)根据晶胞中离子的相对位置判断Ag+的配位数,利用均摊方法计算1个晶胞中含有的AgN5的个数,结合ρ=![]() 计算密度大小。
计算密度大小。
(1)Mn是25号元素,根据构造原理可得Mn原子的核外电子排布式为1s22s22p63s23p63d54s2,Mn原子失去最外层2个电子得到Mn2+,其价电子排布式为3d5;Ag、Cu在周期表中位于第IB,发生变化的电子有最外层的s电子和次外层的d电子,属于ds区元素;
(2)①X的第一、第二电离能比较小且很接近,说明X原子最外层有2个电子,容易失去,则X为Mg元素,Z的第一电离能在三种元素中最大,结合N原子2p轨道处于半充满的稳定状态,其失去第一个电子较难,I1较大,可推知Z为N元素,Y是O元素;
②在该晶体中阳离子[Mg(H2O)6]2+的中心离子Mg2+含有空轨道,而配位体H2O的O原子上含有孤电子对,在结合时,Mg2+提供空轨道,H2O的O原子提供孤电子对,二者形成配位键;在阴离子[(N5)2(H2O)4]2-上N5-与H2O的H原子之间通过氢键结合在一起,形成N…H-O,故二者之间作用力为氢键;
③若原子采用sp3杂化,形成的物质结构为四面体形;若原子采用sp2杂化,形成的物质结构为平面形;若原子采用sp杂化,则形成的为直线型结构。N5-为平面正五边形,说明N原子的杂化类型为sp2杂化;在N5-中,每个N原子的sp2杂化轨道形成2个σ键,N原子上还有1个孤电子对及1个垂直于N原子形成平面的p轨道,p轨道间形成大π键,N5-为4个N原子得到1个电子形成带有1个单位负电荷的阴离子,所以含有的电子数为5个,其中大π键是由4个原子、5个电子形成,可表示为![]() ;
;
(3)根据AgN5的晶胞结构示意图可知,假设以晶胞顶点Ag+为研究对象,在晶胞中与该Ag+距离相等且最近的Ag+在晶胞面心上,通过该顶点Ag+可形成8个晶胞,每个面心上的Ag+被重复使用了2次,所以与Ag+距离相等且最近的Ag+的数目为![]() =12个;在一个晶胞中含有Ag+的数目为8×
=12个;在一个晶胞中含有Ag+的数目为8×![]() +6×
+6×![]() =4,含有N5-的数目为1+12×
=4,含有N5-的数目为1+12×![]() =4,晶胞体积为V=(2a×10-7)3 cm3,则ρ=
=4,晶胞体积为V=(2a×10-7)3 cm3,则ρ=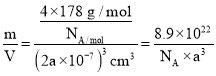 g/cm3。
g/cm3。

【题目】原子序数依次增大的X、Y、Z、G、Q、R、T七种元素,核电荷数均小于36。已知X的一种1∶2型氢化物分子中既有σ键又有π键,且所有原子共平面;Z的L层上有2个未成对电子;Q原子的s能级与p能级电子数相等;R单质是制造各种计算机、微电子产品的核心材料;T处于周期表的ds区,原子中只有一个未成对电子。
(1)Y原子核外共有________种不同运动状态的电子,基态T原子有________种不同能级的电子。
(2)X、Y、Z的第一电离能由小到大的顺序为_______________(用元素符号表示)。
(3)由X、Y、Z形成的离子ZXY-与XZ2互为等电子体,则ZXY-中X原子的杂化轨道类型为_______________________。
(4)Z与R能形成化合物甲,1 mol甲中含________mol化学键,甲与氢氟酸反应,生成物的分子空间构型分别为___________________。
(5)G、Q、R氟化物的熔点如下表,造成熔点差异的原因为_________________。
氟化物 | G的氟化物 | Q的氟化物 | R的氟化物 |
熔点/K | 993 | 1539 | 183 |
(6)向T的硫酸盐溶液中逐滴加入Y的氢化物的水溶液至过量,反应的离子方程式为___________,
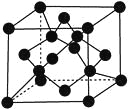
(7)X单质的晶胞如图所示,一个X晶胞中有________个X原子。